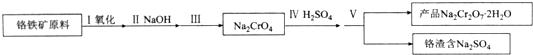
题目内容
3. 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol.
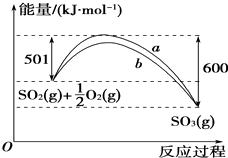
(2)如图是SO2生成SO3反应过程中能量变化的曲线图.该反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1.
(3)拆开1mol H-H键、1mol N-H键、1mol N≡N键需要的能量分别是436kJ、391kJ、946kJ,则1mol N2完全反应生成NH3的反应热△H为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,1mol H2完全反应生成NH3所放出的热量为30.67KJ.
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)图象分析可知是1molSO2和0.5mol氧气完全反应生成1molSO3,反应是放热反应,反应的焓变△H=501KJ/mol-600KJ/mol=99KJ/mol,据此写出反应的热化学方程式;
(3)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,则热化学方程式为:S(s)+O2(g)=SO2(g);△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)=SO2(g);△H=-296.8 kJ/mol;
(2)图象分析可知,图象中表示的是1molSO2和0.5mol氧气完全反应生成1molSO3,反应是放热反应,反应的焓变△H=501KJ/mol-600KJ/mol=99KJ/mol,2mol二氧化硫全部反应放热198 kJ;写出反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-198 kJ•mol-1 ,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-198 kJ•mol-1 ;
(3)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,1mol H2完全反应生成NH3所放出的热量=$\frac{92}{3}$KJ=30.67KJ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,30.67KJ.
点评 本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,注意键能计算焓变的方法,题目难度中等,注重基础知识的考查.

| A. | 右 (M+2Q) | B. | 左 (M+2Q) | C. | 右 (M+4Q) | D. | 左 (M+4Q) |
| A. | KClO3和SO2溶于水后的溶液均可导电,故KClO3和SO2均为电解质 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| C. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下自发进行,则该反应的△H<0 | |
| D. | 向浓度均为0.1mol•L-1KI和NaCl混合溶液中,滴加几滴硝酸镍溶液,只得到AgI沉淀说明Ksp(Agl)<Ksp(AgCl) |

| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
在A中加入30.0mL无水苯和少量铁屑.在B中小心加入8.0mL液态溴.向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏.
①A的容积最适合的是c(填编号).
a.25mL b.50mL c.100mL d.250mL
②收集溴苯时,应根据C2(填“C1”或“C2”)所显示的温度,其温度应为156℃.
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,则用它可吸收承接到的所有物质有Br2、HBr、C6H6(填化学名称).
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应.
第一步:取少量反应后F装置中的溶液于试管中;
第二步:向其中加入过量的稀硝酸;
第三步:继续滴加少量的硝酸银溶液.如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应.
该实验方案不合理(填“合理”或“不合理”),理由是溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应.
| A. | Al3+ | B. | Al(OH)3 | C. | AlO2- | D. | Al3+ Al(OH)3 |