题目内容
(1)把260g含有二氧化硅的碳酸钙固体在高温下加热到质量不再改变,冷却后称量为172g.计算原物质中二氧化硅的质量是多少?
(2)在由Fe、Fe2O3组成的混合物中加入100mL2mol?L-1的盐酸,恰好使混合物完全溶解,并放出224mL气体(标准状况),此时向溶液中加入KSCN溶液无明显现象,求反应前混合物中Fe、Fe2O3的物质的量.
(2)在由Fe、Fe2O3组成的混合物中加入100mL2mol?L-1的盐酸,恰好使混合物完全溶解,并放出224mL气体(标准状况),此时向溶液中加入KSCN溶液无明显现象,求反应前混合物中Fe、Fe2O3的物质的量.
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:(1)在高温下加热SiO2和CaCO3固体混合物,发生反应:CaCO3+SiO2
CaSiO3+CO2↑,碳酸钙过量,发生反应:CaCO3
CaO+CO2↑,质量的减少为生成CO2的质量,根据碳原子守恒n(CaCO3)=n(CO2),再根据m=nM计算碳酸钙的质量,进而计算计算二氧化硅的质量;
(2)混合物与盐酸恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeCl2,发生反应:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,设原混合物中Fe和Fe2O3的物质的量分别为xmol、ymol,计算出与HCl反应的Fe的物质的量,进而表示出与Fe3+反应的Fe的物质的量,据此列方程,再根据氯元素守恒列方程,联立方程计算解答.
| ||
| ||
(2)混合物与盐酸恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeCl2,发生反应:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,设原混合物中Fe和Fe2O3的物质的量分别为xmol、ymol,计算出与HCl反应的Fe的物质的量,进而表示出与Fe3+反应的Fe的物质的量,据此列方程,再根据氯元素守恒列方程,联立方程计算解答.
解答:
解:(1)在高温下加热SiO2和CaCO3固体混合物,发生反应:CaCO3+SiO2
CaSiO3+CO2↑,碳酸钙过量,发生反应:CaCO3
CaO+CO2↑,质量的减少为生成CO2的质量,生成的二氧化碳的气体的质量为:260g-172g=88g,其物质的量=
=2mol,根据碳原子守恒,n(CaCO3)=n(CO2)=2mol,故m(CaCO3)=2mol×100g/mol=200g,则二氧化硅的质量=260g-200g=60g,
答:二氧化硅的质量是60g.
(2)混合物与盐酸恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeCl2,生成氢气物质的量为:
=0.01mol,
Fe+2H+=Fe2++H2↑
0.01mol 0.01mol
设原混合物中Fe和Fe2O3的物质的量分别为xmol、ymol,
Fe2O3~2Fe3+~Fe
ymol (x-0.01)mol
根据题意,列方程得:x-0.01=y
根据氯元素守恒:2x+2y×2=0.1×2
联立方程,解得x=0.04mol,y=0.03mol
答:反应前混合物中Fe为0.04mol、Fe2O3为0.03mol.
| ||
| ||
| 88g |
| 44g/mol |
答:二氧化硅的质量是60g.
(2)混合物与盐酸恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeCl2,生成氢气物质的量为:
| 0.224L |
| 22.4L/mol |
Fe+2H+=Fe2++H2↑
0.01mol 0.01mol
设原混合物中Fe和Fe2O3的物质的量分别为xmol、ymol,
Fe2O3~2Fe3+~Fe
ymol (x-0.01)mol
根据题意,列方程得:x-0.01=y
根据氯元素守恒:2x+2y×2=0.1×2
联立方程,解得x=0.04mol,y=0.03mol
答:反应前混合物中Fe为0.04mol、Fe2O3为0.03mol.
点评:本题考查混合物计算,侧重学生的分析计算能力,(1)中注意根据碳元素守恒计算碳酸钙的质量,(2)中判断产物是关键,注意原子守恒利用,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
根据如图所示的反应判断下列说法中错误的是( )


| A、CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量 |
| B、该反应的焓变大于零 |
| C、该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量 |
| D、由该反应可推出凡是需要加热才发生的反应均为吸热反应 |
对于化学反应:2Na+2H2O═2NaOH+H2↑的有关叙述错误的是( )
| A、该反应中既有旧化学键的断裂,也有新化学键的生成 |
| B、该反应中每消耗1molNa,则同时消耗18gH2O,产生1molNaOH和11.2LH2(标况下) |
| C、由于该反应常温下能自动进行,所以该反应一定是放热反应 |
| D、由于该反应是放热反应,所以断裂旧化学键所吸收的能量一定比形成新化学键所放出的能量少 |
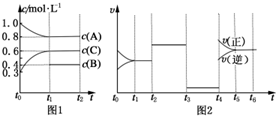 向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.
向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件. HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.
HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.
