题目内容
关于Na2CO3和NaHCO3的说法正确的是( )
| A、同浓度,Na2CO3的碱性小于NaHCO3 |
| B、与盐酸反应,NaHCO3的反应速率小于Na2CO3 |
| C、可以用氢氧化钡溶液区分Na2CO3和NaHCO3 |
| D、NaHCO3的溶解度小于Na2CO3 |
考点:钠的重要化合物
专题:元素及其化合物
分析:NaHCO3与Na2CO3相比较,NaHCO3不稳定,加热易分解,常温时,Na2CO3溶解度较大、水解程度较大,与盐酸反应时,NaHCO3反应剧烈,二者都可与氢氧化钡反应生成沉淀,以此解答该题.
解答:
解:A.Na2CO3和NaHCO3都为强碱弱酸盐,水解呈碱性,且Na2CO3水解程度比大NaHCO3,故A错误;
B.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故B错误;
C.加入氢氧化钡,与碳酸钠以及碳酸氢钠都反应生成白色沉淀碳酸钡,不能鉴别,故C错误;
D.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,故D正确.
故选D.
B.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故B错误;
C.加入氢氧化钡,与碳酸钠以及碳酸氢钠都反应生成白色沉淀碳酸钡,不能鉴别,故C错误;
D.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,故D正确.
故选D.
点评:该题考查碳酸钠与碳酸氢钠的性质比较,是高考中的常见题型,属于中等难度试题的考查.该题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力.

练习册系列答案
相关题目
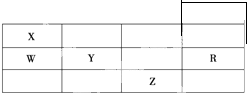 如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )
如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )| A、X、Z元素都能够形成双原子分子 |
| B、W、R元素单质分子内的化学键都是非极性键 |
| C、键长X-H<W-H,键能X-H<W-H |
| D、键能W-H>Y-H,键的极性Y-H>W-H |
下列各组物质的最简式相同的是( )
| A、乙酸和乙二酸 |
| B、丁酸和乙酸 |
| C、甲醛和乙酸 |
| D、乙二酸和乙二醇 |
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,不正确的是( )


| A、A分子属于酯类化合物,在一定条件下能发生水解反应 |
| B、符合题中A分子结构特征的有机物有2种 |
| C、A在一定条件下可与3mol H2发生加成反应 |
| D、分子式为C8H8O2且分子中含苯环和一COOR(-R为烃基)的物质共有6种 |
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质浓度、反应温度等有关.下列各组物质:
①Cu与HNO3溶液 ②Fe与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是( )
①Cu与HNO3溶液 ②Fe与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是( )
| A、①② | B、①③ | C、③④ | D、②④ |
下列定量仪器读数正确的是( )
A、 8.0mL |
B、 24.00g |
C、 23.65mL |
D、 38.2℃ |
已知NO,NO2与NaOH溶液的反应为NO+NO2+2NaOH=2NaNO2+H2O现将n mol NO和m mol NO2(m>n)所组成的混合气通入某浓度的NaOH溶液中,完全反应后用去了NaOH 溶液V L,则此NaOH溶液的浓度为( )mol?L -1.
A、
| ||
B、
| ||
C、
| ||
D、
|
下列叙述正确的是( )
| A、溶液和胶体的本质区别是有无丁达尔效应 |
| B、常用的危险化学品酒精和甲烷的标志都是易燃液体 |
| C、氧化钠和过氧化钠中氧元素的化合价都是-2价 |
| D、由同种分子构成的物质一定是纯净物 |