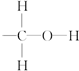
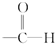题目内容
某二元酸(H2A)在水中的电离方程式是:
H2A=H++HA- HA-?H++A2-
回答下列问题:
(1)请判断H2A是强电解质还是弱电解质? ,理由是 .
(2)已知0.1mol?L-1NaHA溶液的pH=2,则0.1mol?L-1 H2A溶液中氢离子的物质的量浓度应 0.11mol?L-1(填“<”,“>”或“=”),理由是:
(3)Na2A溶液显 (填“酸性”,“中性”或“碱性”).理由是 (用离子方程式表示)
(4)H2A溶液和Na2A溶液能否发生反应? 能反应的写出离子方程式 .
H2A=H++HA- HA-?H++A2-
回答下列问题:
(1)请判断H2A是强电解质还是弱电解质?
(2)已知0.1mol?L-1NaHA溶液的pH=2,则0.1mol?L-1 H2A溶液中氢离子的物质的量浓度应
(3)Na2A溶液显
(4)H2A溶液和Na2A溶液能否发生反应?
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)在水溶液里或熔融状态下部分电离的电解质为弱电解质,完全电离的电解质为强电解质;
(2)根据电离方程式知,HA-只电离不水解,0.1mol?L-1NaHA溶液的pH=2,则HA-电离出氢离子浓度为0.01mol/L,H2A第一步电离出的氢离子抑制第二步电离;
(3)发生水解反应A2-+H2O?OH-+HA-,导致溶液呈碱性;
(4)H2A和Na2A反应生成NaHA.
(2)根据电离方程式知,HA-只电离不水解,0.1mol?L-1NaHA溶液的pH=2,则HA-电离出氢离子浓度为0.01mol/L,H2A第一步电离出的氢离子抑制第二步电离;
(3)发生水解反应A2-+H2O?OH-+HA-,导致溶液呈碱性;
(4)H2A和Na2A反应生成NaHA.
解答:
解:(1)根据H2A=H++HA-知,H2A第一步完全电离,所以为强电解质,故答案为:强电解质;H2A第一步完全电离;
(2)根据电离方程式知,HA-只电离不水解,0.1mol?L-1NaHA溶液的pH=2,则HA-电离出氢离子浓度为0.01mol/L,H2A第一步完全电离生成0.1mol/L的氢离子,第一步电离出的氢离子抑制第二步电离,所以第二步电离出的氢离子浓度小于0.01mol/L,则H2A溶液中氢离子的物质的量浓度应小于0.11mol/L,
故答案为:<;HA-部分电离且H2A第一步电离出的氢离子抑制第二步电离;
(3)发生水解反应A2-+H2O?OH-+HA-,导致溶液呈碱性,故答案为:碱性;A2-+H2O?OH-+HA-;
(4)根据H2A=H++HA-、HA-?H++A2-知,H2A第一步完全电离、第二步部分电离,所以H2A和Na2A反应生成NaHA,离子方程式为A2-+H+=HA-,故答案为:能;A2-+H+=HA-.
(2)根据电离方程式知,HA-只电离不水解,0.1mol?L-1NaHA溶液的pH=2,则HA-电离出氢离子浓度为0.01mol/L,H2A第一步完全电离生成0.1mol/L的氢离子,第一步电离出的氢离子抑制第二步电离,所以第二步电离出的氢离子浓度小于0.01mol/L,则H2A溶液中氢离子的物质的量浓度应小于0.11mol/L,
故答案为:<;HA-部分电离且H2A第一步电离出的氢离子抑制第二步电离;
(3)发生水解反应A2-+H2O?OH-+HA-,导致溶液呈碱性,故答案为:碱性;A2-+H2O?OH-+HA-;
(4)根据H2A=H++HA-、HA-?H++A2-知,H2A第一步完全电离、第二步部分电离,所以H2A和Na2A反应生成NaHA,离子方程式为A2-+H+=HA-,故答案为:能;A2-+H+=HA-.
点评:本题考查弱电解质的电离,注意题干信息中H2A的两步电离不同,第一步完全电离、第二步部分电离,导致HA-只电离不水解,为易错题.

练习册系列答案
相关题目
关于Na2CO3和NaHCO3的说法正确的是( )
| A、同浓度,Na2CO3的碱性小于NaHCO3 |
| B、与盐酸反应,NaHCO3的反应速率小于Na2CO3 |
| C、可以用氢氧化钡溶液区分Na2CO3和NaHCO3 |
| D、NaHCO3的溶解度小于Na2CO3 |
白磷会对人体造成严重的烧伤,白磷(P4)分子结构为 .下列说法不正确的是( )
.下列说法不正确的是( )
 .下列说法不正确的是( )
.下列说法不正确的是( )| A、白磷着火点低,在空气中可自燃 |
| B、白磷、红磷互为同素异形体 |
| C、31g白磷中,含P-P键1.5 mol |
| D、已知P4(白磷,s)+3O2(g)═2P2O3(s)△H=-Q kJ?mol-1,则白磷的燃烧热为Q kJ?mol-1 |
下列物质的溶液中,存在电解质电离平衡的是( )
| A、Ba(OH)2 |
| B、CH3COOH |
| C、CH3COONa |
| D、H2SO4 |