题目内容
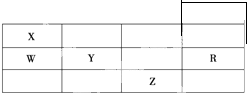 如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )
如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )| A、X、Z元素都能够形成双原子分子 |
| B、W、R元素单质分子内的化学键都是非极性键 |
| C、键长X-H<W-H,键能X-H<W-H |
| D、键能W-H>Y-H,键的极性Y-H>W-H |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.氮气分子、溴单质分子都是双原子分子;
B.稀有气体不存在化学键;
C.根据原子半径判断键长,键长越短化学键越稳定,键能越大;
D.键长越长,键能越小,元素电负性相差越大,形成分子极性越大.
A.氮气分子、溴单质分子都是双原子分子;
B.稀有气体不存在化学键;
C.根据原子半径判断键长,键长越短化学键越稳定,键能越大;
D.键长越长,键能越小,元素电负性相差越大,形成分子极性越大.
解答:
解:由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.氮气分子、溴单质分子都是双原子分子,故A正确;
B.稀有气体不存在化学键,故B错误;
C.原子半径X<W,故键长X-H<W-H,键长越短化学键越稳定,键能X-H>W-H,故C错误;
D.原子半径W>Y,键长W-H>Y-H,故键能W-H<Y-H,电负性W<Y,故键的极性Y-H>W-H,故D错误,
故选A.
A.氮气分子、溴单质分子都是双原子分子,故A正确;
B.稀有气体不存在化学键,故B错误;
C.原子半径X<W,故键长X-H<W-H,键长越短化学键越稳定,键能X-H>W-H,故C错误;
D.原子半径W>Y,键长W-H>Y-H,故键能W-H<Y-H,电负性W<Y,故键的极性Y-H>W-H,故D错误,
故选A.
点评:本题考查元素周期表、化学键等,难度不大,注意理解键参数与分子结构与性质关系.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
 短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )| A、X是活泼的非金属 |
| B、三种元素中Y的非金属性最强 |
| C、Z的最高价氧化物的水化物是强酸 |
| D、Y的最高价氧化物的水化物是一种强酸 |
下列各组物质中,不管它们以何种比例混合只要总质量一定,充分燃烧后生成的二氧化碳的质量不变的是( )
| A、乙炔和苯 |
| B、乙醇和丙醇(CH3CH2CH2OH) |
| C、乙酸和乙二醇(HOCH2-CH2OH) |
| D、甲醇CH3OH和乙酸 |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3 区域的是( )


| A、Cl2+2KBr═Br2+2KCl | ||||
| B、2NaHCO3═Na2CO3+H2O+CO2↑ | ||||
C、4Fe(OH)2+O2+2H2O
| ||||
| D、2Na2O2+2CO2═2Na2CO3+O2 |
同温下,有甲、乙两瓶醋酸稀溶液,测得甲pH=a,乙pH=a+1,下列推断正确的是( )
| A、物质的量浓度c(甲)是c(乙)的10倍 |
| B、溶液中的c(OH-)甲是乙的10倍 |
| C、由水电离产生的c(H+)乙是甲的10倍 |
| D、与等量的NaOH反应消耗甲、乙两酸的体积V(甲)>10V(乙) |
某烯烃(只含一个碳碳双键)与氢气加成后的产物是:则该烯烃的结构式可能有几种( )


| A、1 | B、2 | C、3 | D、4 |
关于Na2CO3和NaHCO3的说法正确的是( )
| A、同浓度,Na2CO3的碱性小于NaHCO3 |
| B、与盐酸反应,NaHCO3的反应速率小于Na2CO3 |
| C、可以用氢氧化钡溶液区分Na2CO3和NaHCO3 |
| D、NaHCO3的溶解度小于Na2CO3 |