题目内容
Ⅰ、HCOOH是一种无色、易挥发的液体,某学习小组参照:HCOOH
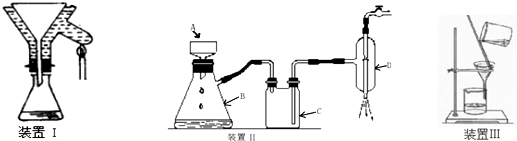
H2O+CO↑,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末.

(1)若所制气体流向从左向右时,上述仪器连接为:
A→ → → → →
(2)A装置中小试管的作用(至少答两条):① .② .
(3)证明HCOOH受热产物中有CO的现象为: .
(4)本实验有3处用到酒精灯,除A、B处外,还缺一个酒精灯,应放在 处.
Ⅱ、学习小组查阅资料知:
①Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色.
②4CuO
2Cu2O+O2↑
③Cu2O+2H+═Cu+Cu2++H2O
因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:
方案①:取该红色固体溶于足量稀硝酸中,观察溶液颜色的变化.
方案②:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化.
(5)写出Cu2O与稀硝酸反应的化学方程式: .
(6)请你评价方案②的合理性,并简述理由:方案②: ,理由: .
| 浓H2SO4 |
| △ |

(1)若所制气体流向从左向右时,上述仪器连接为:
A→
(2)A装置中小试管的作用(至少答两条):①
(3)证明HCOOH受热产物中有CO的现象为:
(4)本实验有3处用到酒精灯,除A、B处外,还缺一个酒精灯,应放在
Ⅱ、学习小组查阅资料知:
①Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色.
②4CuO
| ||
③Cu2O+2H+═Cu+Cu2++H2O
因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:
方案①:取该红色固体溶于足量稀硝酸中,观察溶液颜色的变化.
方案②:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化.
(5)写出Cu2O与稀硝酸反应的化学方程式:
(6)请你评价方案②的合理性,并简述理由:方案②:
考点:制备实验方案的设计
专题:实验设计题
分析:(1)用仪器组装设备的顺序是制取气体的装置、然后除杂、干燥装置、检验装置、反应装置、检验装置、尾气处理装置.有时为了安全起见,要加一个安全瓶,来防止倒吸现象的发生;
(2)A装置中小试管的作用①液封,防止气体从长颈漏斗中溢出;②节约试剂;③便于控制反应;
(3)若有CO气体产生,则在B中会发生反应:CuO+C
CO2+Cu,Cu是红色固体,CO2能使澄清的石灰水变浑浊.因此要证明HCOOH受热产物中有CO的现象为B中黑色固体变为红色,D中溶液变浑浊;
(4)本实验有3处用到酒精灯,在A用于制取CO气体,在B处用于使CO与CuO发生氧化还原反应,在D处用于除去过量的CO,防止污染大气;
(5)Cu2O与稀硝酸发生氧化还原反应硝酸铜、一氧化氮和水;
(6)若固体是Cu单质,与稀硫酸不反应,若固体含有Cu2O,加入稀硫酸会发生反应:Cu2O+2H+=Cu+Cu2++H2O,会产生Cu2+,使溶液变蓝;
(2)A装置中小试管的作用①液封,防止气体从长颈漏斗中溢出;②节约试剂;③便于控制反应;
(3)若有CO气体产生,则在B中会发生反应:CuO+C
| ||
(4)本实验有3处用到酒精灯,在A用于制取CO气体,在B处用于使CO与CuO发生氧化还原反应,在D处用于除去过量的CO,防止污染大气;
(5)Cu2O与稀硝酸发生氧化还原反应硝酸铜、一氧化氮和水;
(6)若固体是Cu单质,与稀硫酸不反应,若固体含有Cu2O,加入稀硫酸会发生反应:Cu2O+2H+=Cu+Cu2++H2O,会产生Cu2+,使溶液变蓝;
解答:
解:(1)用仪器组装设备的顺序是制取气体的装置、然后除杂、干燥装置、检验装置、反应装置、检验装置、尾气处理装置.有时为了安全起见,要加一个安全瓶,来防止倒吸现象的发生.因此若所制气体流向从左向右时,装置的连接顺序是A→F→C→E→B→D;
故答案为:F、C、E、B、D;
(2)依据装置和实验目的分析,A装置中小试管的作用①液封,防止气体从长颈漏斗中溢出;②节约试剂;③便于控制反应;
故答案为:①液封,防止气体从长颈漏斗中溢出;②节约试剂;便于控制反应;
(3)若有CO气体产生,则在B中会发生反应:CuO+C
CO2+Cu,Cu是红色固体,CO2能使澄清的石灰水变浑浊.因此要证明HCOOH受热产物中有CO的现象为B中黑色固体变为红色,D中溶液变浑浊;
故答案为:B中黑色固体变为红色,D中溶液变浑浊;
(4)本实验有3处用到酒精灯,在A用于制取CO气体,在B处用于使CO与CuO发生氧化还原反应,在D处用于除去过量的CO,防止污染大气;
故答案为:D;
(5)Cu2O与稀硝酸发生氧化还原反应的化学方程式是:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O;
故答案为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O;
(6)若固体是Cu单质,与稀硫酸不反应,若固体含有Cu2O,加入稀硫酸会发生反应:Cu2O+2H+=Cu+Cu2++H2O,会产生Cu2+,使溶液变蓝,因此方案②合理;
故答案为:合理,因为Cu2O可与稀硫酸溶液反应生成Cu2+,会使溶液变蓝;
故答案为:F、C、E、B、D;
(2)依据装置和实验目的分析,A装置中小试管的作用①液封,防止气体从长颈漏斗中溢出;②节约试剂;③便于控制反应;
故答案为:①液封,防止气体从长颈漏斗中溢出;②节约试剂;便于控制反应;
(3)若有CO气体产生,则在B中会发生反应:CuO+C
| ||
故答案为:B中黑色固体变为红色,D中溶液变浑浊;
(4)本实验有3处用到酒精灯,在A用于制取CO气体,在B处用于使CO与CuO发生氧化还原反应,在D处用于除去过量的CO,防止污染大气;
故答案为:D;
(5)Cu2O与稀硝酸发生氧化还原反应的化学方程式是:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O;
故答案为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O;
(6)若固体是Cu单质,与稀硫酸不反应,若固体含有Cu2O,加入稀硫酸会发生反应:Cu2O+2H+=Cu+Cu2++H2O,会产生Cu2+,使溶液变蓝,因此方案②合理;
故答案为:合理,因为Cu2O可与稀硫酸溶液反应生成Cu2+,会使溶液变蓝;
点评:本题考查了物质制备实验方法和注意问题,过程分析判断,实验基本操作的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
对于重水D2O,在25℃时KW=10-12,定义pD=-lg{c(D+)},pOD=-lg{c(OD-)}.则下列说法正确的是( )
| A、25℃时,纯重水pD=7 |
| B、25℃时,0.1mol/L NaCl的重水溶液pD=pOD=6 |
| C、25℃时,1mol/L的DCl的重水溶液pD=0,pOD=14 |
| D、25℃时,0.01mol/L NaOD的重水溶液中pD=12 |
苹果酸的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A、苹果酸中能发生酯化反应的官能团有2种 |
| B、1 mol苹果酸可与3 mol NaOH发生中和反应 |
| C、1 mol苹果酸与足量金属Na反应生成1 mol H2 |
D、 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
已知在中性条件下钢铁易发生吸氧腐蚀时,正极上发生的电极反应是( )
| A、2H++2e-→H2 |
| B、Fe2++3e→Fe |
| C、2H2O+O2+4e-→4OH- |
| D、Fe3+-e→Fe3+ |