题目内容
14.卫星发射时可用肼作燃料.1 mol N2H4 在O 2 中燃烧生成N 2 (g)和H 2 O(l)时,放出534 kJ热量,则其热化学方程式为N2H4(l)+O2(g)=N2 (g)+2H2O(l)△H=-534kJ/mol.分析 1 mol N2H4 在O 2 中燃烧生成N2 (g)和H2O(l)时,放出534 kJ热量,可知焓变为负,结合物质的状态书写热化学方程式,以此来解答.
解答 解:1 mol N2H4 在O2 中燃烧生成N2 (g)和H2O(l)时,放出534 kJ热量,则热化学方程式为N2H4(l)+O2(g)=N2 (g)+2H2O(l)△H=-534kJ/mol,
故答案为:N2H4(l)+O2(g)=N2 (g)+2H2O(l)△H=-534kJ/mol.
点评 本题考查热化学方程式的书写,为高频考点,把握反应中能量变化、焓变、物质的状态为解答的关键,侧重分析与应用能力的考查,注意反应热的判断,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
3.以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
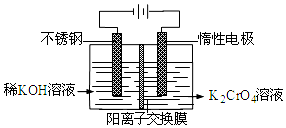

| A. | 在阴极式,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 铬原子的价电子排布式为3d44S2 |
2.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量稀盐酸,固体全部溶解;再加入过量烧碱溶液,有白色沉淀产生;
②取少量样品加入足量水,固体全部溶解;再加入稀硫酸,有白色沉淀产生.
该白色粉末可能为( )
①取少量样品加入足量稀盐酸,固体全部溶解;再加入过量烧碱溶液,有白色沉淀产生;
②取少量样品加入足量水,固体全部溶解;再加入稀硫酸,有白色沉淀产生.
该白色粉末可能为( )
| A. | BaCl2、Al(NO3)3 | B. | BaCO3、MgCl2 | C. | MgSO4、AlCl3 | D. | Ba(NO3)2、Mg(NO3)2 |
9.下列说法正确的是( )
| A. | 在相同条件下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度不相同 | |
| B. | 反应NH3(g)+HCl(g)?NH4Cl(s)能自发进行,则该反应△H<0 | |
| C. | 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了 c(H+) | |
| D. | 一定条件下,反应2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡后,升高体系温度,应重新达到平衡前,有v正(O2)>2v逆(SO2) |
19.对于 CH3-C≡C-CH3分子,下列说法正确的是( )
| A. | 四个碳原子不可能在一条直线上 | B. | 所有原子在同一平面内 | ||
| C. | 在同一直线上的原子最多为4个 | D. | 在同一直线上的原子最多为6个 |
6.设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A. | 标准状况下,22.4 L乙烯含有的共用电子对数为5NA | |
| B. | lmolNaHSO4中的阳离子数为2NA | |
| C. | 通常状况下,lmolNO和0.5molO2在密闭容器中混合,生成NO2分子数为NA | |
| D. | 制取漂白粉时,标准状况下22.4LC12参加反应,转移电子数为NA |
3.NaOH固体溶于水,放出大量的热量是因为( )
| A. | 发生水合过程,并且放出热量 | |
| B. | 发生扩散过程,并且放出热量 | |
| C. | 水合过程放出的热量大于扩散过程吸收的热量 | |
| D. | 扩散过程放出的热量大于水合过程吸收的热量 |
4.能源、环境与生产生活和社会发展密切相关.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如表:
①下列情况能说明该反应一定达到平衡状态的是cd(填字母).
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是bd(填字母).
a.降低温度b.充入更多的H2c.移除甲醇d.增大容器体积
③c1=c2(填“>”“<”或“=”),a=19.6.
④该温度下反应的平衡常数K=$\frac{25}{12}$(或2.1);若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
(2)已知反应:2NO2(红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是B(填字母).
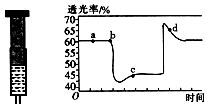
A.b点的操作是拉伸注射器
B.d点:v正<v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如表:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH (g)和 1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是bd(填字母).
a.降低温度b.充入更多的H2c.移除甲醇d.增大容器体积
③c1=c2(填“>”“<”或“=”),a=19.6.
④该温度下反应的平衡常数K=$\frac{25}{12}$(或2.1);若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
(2)已知反应:2NO2(红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是B(填字母).

A.b点的操作是拉伸注射器
B.d点:v正<v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc.
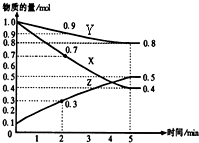 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示: