题目内容
4.解释下列现象的化学用语正确的是( )| A. | 铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e-═Fe3+ | |
| B. | 氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+NH4+═Mg2++NH3•H2O | |
| C. | 向足量铝粉与氢氧化钠溶液反应后的溶液中滴加碳酸氢钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| D. | 漂白粉溶液中加氯化亚铁溶液产生大量沉淀:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
分析 A.金属铁电化学腐蚀中,金属铁是电子只能成为亚铁离子;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.硫酸根离子完全沉淀,则明矾与氢氧化钡按照1:2反应,铝离子恰好反应生成偏铝酸根离子;
D.次氯酸具有强氧化性,能够将氢氧化亚铁氧化成氢氧化铁.
解答 解:A.金属铁电化学腐蚀中,金属铁是电子只能成为亚铁离子,正确的反应为:Fe-2e-=Fe2+,故A错误;
B.氢氧化镁白色沉淀溶于氯化铵溶液,反应生成镁离子和一水合氨,正确的离子方程式为:Mg(OH)2+2NH4+═Mg2++2NH3•H2O,故B错误;
C.足量铝粉与氢氧化钠溶液反应后的溶液中含有偏铝酸根了,碳酸氢根离子的酸性大于氢氧化铝,滴加碳酸氢钠溶液后生成氢氧化铝沉淀碳酸根离子,反应的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32-,故C正确;
D.漂白粉溶液中加氯化亚铁溶液,亚铁离子被氧化成铁离子,正确的离子方程式为:2Fe2++5ClO-+5H2O═2Fe(OH)3↓+4HClO+Cl-,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
14.溶液的PH与所加水的质量关系图符合的是( )
| A. | 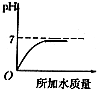 | B. | 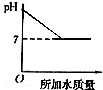 | C. | 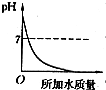 | D. | 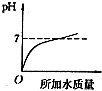 |
15.将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上 + →______+______+______+______ 组成一个未配平的化学方程式,正确的顺序是( )
| A. | FeSO4、Fe(NO3)3; Fe2(SO4)3、HNO3、N2O、H2O | |
| B. | HNO3、FeSO4; Fe2(SO4)3、Fe(NO3)3、N2O、H2O | |
| C. | HNO3、Fe2(SO4)3; FeSO4、Fe(NO3)3、N2O、H2O | |
| D. | Fe2(SO4)3、N2O; FeSO4、HNO3、Fe(NO3)3、H2O |
12.下列过程不涉及氧化还原反应的是( )
| A. | 明矾净水 | B. | 工业固氮 | C. | 海水提镁 | D. | 电池充电 |
10.某水溶液只可能含有K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-中的若干种离子.某同学取100mL的溶液分成两等份进行如下实验:
①第一份加过量的氢氧化钠溶液后加热,收集到0.02mol的气体,无沉淀产生,同时得到溶液甲.
②向溶液甲中通过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02g固体.
③第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到11.65g固体.
据此,该同学得到的结论正确的是( )
①第一份加过量的氢氧化钠溶液后加热,收集到0.02mol的气体,无沉淀产生,同时得到溶液甲.
②向溶液甲中通过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02g固体.
③第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到11.65g固体.
据此,该同学得到的结论正确的是( )
| A. | 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.2 mol•L-1 | |
| B. | 实验③中的白色沉淀中一定有BaSO4,无BaCO3 | |
| C. | 原溶液中一定有K+,且c(K+)=0.4 mol•L-1 | |
| D. | 若要判断原溶液中是否有Cl-,无需另外设计实验验证 |
7.某实验小组依据反应 AsO${\;}_{4}^{3-}$+2H++2I-?AsO${\;}_{3}^{3-}$+I2+H2O设计如图原电池,探究pH对AsO4氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )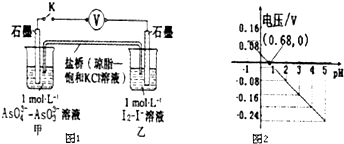

| A. | 调节pH可以改变反应的方向 | |
| B. | pH=0.68 时,反应处于平衡状态 | |
| C. | pH=5 时,负极电极反应式为2I--2e-═I2 | |
| D. | pH>0.68时,氧化性I2>AsO${\;}_{4}^{3-}$ |
8.下列各组离子在溶液中能够大量共存的是( )
| A. | K+、Cl-、NO3-、Ag+ | B. | H+、HCO3-、Na+、Cl- | ||
| C. | Na+、OH-、Ba2+、CO32- | D. | Mg2+、Cl-、H+、SO42- |
