题目内容
9.元素Q、R、J、T、Z在周期表中的位置如图所示,关于这些元素的叙述正确的是( )
| A. | 元素第一电离能大小:J>R>Q | |
| B. | 含T元素的两种盐的溶液,一定不能相互反应 | |
| C. | Z的含氧酸一定为强酸 | |
| D. | Q、R、J三元素中J的电负性最大 |
分析 由元素Q、R、J、T、Z在周期表中的位置可知,Q为C,R为N,J为O,T为Al,Z为Cl,然后结合元素周期律来解答.
解答 解:由元素Q、R、J、T、Z在周期表中的位置可知,Q为C,R为N,J为O,T为Al,Z为Cl,
A.非金属性越强,第一电离能越大,但N原子的2p为半满稳定结构,则元素第一电离能大小:R>J>Q,故A错误;
B.含T元素的两种盐的溶液,氯化铝和偏铝酸钠可发生相互促进水解反应,故B错误;
C.Z的含氧酸HClO为弱酸,高氯酸为强酸,故C错误;
D.、R、J三元素中J的非金属性最强,则J的电负性最大,故D正确;
故选D.
点评 本题考查位置、结构、性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,注意规律性知识的应用,电离能与电负性为解答的难点,题目难度不大.

练习册系列答案
相关题目
20.某同学在化学实验准备室中发现一瓶露置于空气已久的Ba(OH)2•8H2O试剂.
I.初步推测
(1)室温配制溶液时,发现所取试剂在水中仅部分溶解,烧杯中存在未溶物.并推测未溶物为BaCO3,理由(用化学方程式表示)Ba(OH)2•8H2O+CO2=BaCO3+9H2O.
II.成分检验
假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计实验方案,进行成分检验(不考虑结晶水的检验;室温时BaCO3饱和溶液pH=9.6).
[限选试剂及仪器]
稀盐酸、稀硫酸、NaOH溶液、澄清石灰水;pH计、烧杯、试管、带塞导气管、滴管
(2)请将步骤3填写完整滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中,预期现象是试管中有气泡生成,烧杯中的澄清石灰水变浑浊.
(3)步骤2仅验证试剂中含有Ba2+离子,由此设计步骤4:取适量滤液于烧杯中用pH计测其pH值;若pH>9.6,说明有大量的OH-,说明试剂中有Ba(OH)2.
III.测定试剂中Ba(OH)2•8H2O的含量
(4)某同学拟用重量法测定:准确称取试剂于烧杯中,溶解,过滤.将BaCO3沉淀洗涤、干燥后称量,由此计算含量.该方法不可行的原因是:氢氧化钡在溶解,过滤的过程中吸收空气中的二氧化碳,又产生碳酸钡,对最终测定Ba(OH)2•8H2O的含量产生影响.
(5)进一步完善测定方案如下:
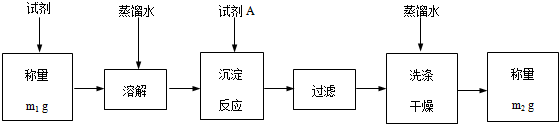
(1)试剂A为碳酸钠.过滤前,检验沉淀是否完全的操作是取上层清液,再滴入一滴试剂A,若无沉淀产生,说明沉淀完全.
(2)该试剂中Ba(OH)2•8H2O(式量:315)的质量分数=$\frac{315(m{\;}_{1}-m{\;}_{2})}{118m{\;}_{1}}$(只列式).$\frac{315(m1-m2)}{118m1}$
(6)如果m1 g试剂反应后得到的沉淀的准确值为m3 g,则测定的相对误差为$\frac{m{\;}_{2}-m{\;}_{3}}{m{\;}_{3}}$;当相对误差为负值时,说明Ba(OH)2•8H2O的含量测定结果偏大(填:偏大或偏小).
I.初步推测
(1)室温配制溶液时,发现所取试剂在水中仅部分溶解,烧杯中存在未溶物.并推测未溶物为BaCO3,理由(用化学方程式表示)Ba(OH)2•8H2O+CO2=BaCO3+9H2O.
II.成分检验
假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计实验方案,进行成分检验(不考虑结晶水的检验;室温时BaCO3饱和溶液pH=9.6).
[限选试剂及仪器]
稀盐酸、稀硫酸、NaOH溶液、澄清石灰水;pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀 | / |
| 步骤2:取适量步骤1滤液于试管中,滴加稀硫酸 | 生成白色沉淀,说明该试剂中含有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,… | …,说明该试剂中含有BaCO3 |
| 步骤4:… | … |
(3)步骤2仅验证试剂中含有Ba2+离子,由此设计步骤4:取适量滤液于烧杯中用pH计测其pH值;若pH>9.6,说明有大量的OH-,说明试剂中有Ba(OH)2.
III.测定试剂中Ba(OH)2•8H2O的含量
(4)某同学拟用重量法测定:准确称取试剂于烧杯中,溶解,过滤.将BaCO3沉淀洗涤、干燥后称量,由此计算含量.该方法不可行的原因是:氢氧化钡在溶解,过滤的过程中吸收空气中的二氧化碳,又产生碳酸钡,对最终测定Ba(OH)2•8H2O的含量产生影响.
(5)进一步完善测定方案如下:

(1)试剂A为碳酸钠.过滤前,检验沉淀是否完全的操作是取上层清液,再滴入一滴试剂A,若无沉淀产生,说明沉淀完全.
(2)该试剂中Ba(OH)2•8H2O(式量:315)的质量分数=$\frac{315(m{\;}_{1}-m{\;}_{2})}{118m{\;}_{1}}$(只列式).$\frac{315(m1-m2)}{118m1}$
(6)如果m1 g试剂反应后得到的沉淀的准确值为m3 g,则测定的相对误差为$\frac{m{\;}_{2}-m{\;}_{3}}{m{\;}_{3}}$;当相对误差为负值时,说明Ba(OH)2•8H2O的含量测定结果偏大(填:偏大或偏小).
14.利用下列各组中的物质制备并收集少量相应的气体,能采用如图装置的是( )
 ①浓氨水和固体NaOH制NH3
①浓氨水和固体NaOH制NH3
②大理石和稀盐酸制CO2
③过氧化氢溶液和二氧化锰制O2 ④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2
⑥电石和水制C2H2
⑦锌粒和稀硫酸制H2
⑧乙醇和浓硫酸制C2H4.
 ①浓氨水和固体NaOH制NH3
①浓氨水和固体NaOH制NH3 ②大理石和稀盐酸制CO2
③过氧化氢溶液和二氧化锰制O2 ④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2
⑥电石和水制C2H2
⑦锌粒和稀硫酸制H2
⑧乙醇和浓硫酸制C2H4.
| A. | ②③ | B. | ①⑥⑦ | C. | ②⑤⑧ | D. | ①④⑥ |
18.某化学科学探究活动小组进行了下列实验探究:
Ⅰ、某实验室的废液经测定其主要含有乙醇,此外还有丙酮、乙酸和乙酸乙酯.以上各物质的沸点如下:
现拟通过下列步骤回收乙醇和乙酸:①向废液中加入烧碱溶液,调整溶液的pH=10;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃之间的馏出物;④排出蒸馏器中的残液,冷却后向其中加入浓硫酸(过量),然后再放入耐酸蒸馏器中进行蒸馏,收集馏出物,请回答下列问题:
(l)加入烧碱使溶液的 pH=10的目的是使乙酸乙酯充分水解,中和乙酸
(2)在70℃~85℃时馏出物的主要成分为乙醇
(3)在步骤④中加入过量的浓硫酸的目的是(用化学方程式表示)2CH3COONa+H2SO4(浓)→Na2SO4+2CH3COOH
(4)最后蒸馏的温度控制在85℃~125℃之间,经过一段时间后,蒸馏瓶内残留液中溶质的主要成分是硫酸钠、硫酸.
Ⅱ.为探究苯与液溴发生反应的原理,用如图装置进行实验.(夹持装置已略去)
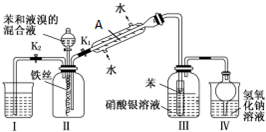
已知:苯与液溴的反应是放热反应.
根据相关知识回答下列问题:
(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始.则Ⅱ中的有机物所发生反应的化学方程式为:
(2)仪器A的名称为:冷凝管.整套实验装置中能防止倒吸的装置有III和IV(填装置序号).
(3)反应结束后,开启K2,关闭K1和分液漏斗活塞,使装置I中的水倒吸入装置Ⅱ中,这样操作的目的是反应结束后装置II中存在大量的溴化氢,使I的水倒吸入II中可以除去溴化氢气体,以免逸出污染空气.
(4)反应结束后,为了得到较纯净的溴苯,对Ⅱ中的溶液按下列步骤分离提纯:
①依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是:除去溴苯中溶有的HBr和Br2
②洗涤后再干燥,即得到粗溴苯,此粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母):
A、重结晶 B、过滤 C、蒸馏 D、萃取
(5)此装置是否能判断苯与溴发生的是取代反应:是,Ⅲ中的广口瓶中出现淡黄色沉淀
(填“是”则写出能说明发生的是取代反应的现象,填“否”则解释其原因.)
Ⅰ、某实验室的废液经测定其主要含有乙醇,此外还有丙酮、乙酸和乙酸乙酯.以上各物质的沸点如下:
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
(l)加入烧碱使溶液的 pH=10的目的是使乙酸乙酯充分水解,中和乙酸
(2)在70℃~85℃时馏出物的主要成分为乙醇
(3)在步骤④中加入过量的浓硫酸的目的是(用化学方程式表示)2CH3COONa+H2SO4(浓)→Na2SO4+2CH3COOH
(4)最后蒸馏的温度控制在85℃~125℃之间,经过一段时间后,蒸馏瓶内残留液中溶质的主要成分是硫酸钠、硫酸.
Ⅱ.为探究苯与液溴发生反应的原理,用如图装置进行实验.(夹持装置已略去)

已知:苯与液溴的反应是放热反应.
根据相关知识回答下列问题:
(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始.则Ⅱ中的有机物所发生反应的化学方程式为:

(2)仪器A的名称为:冷凝管.整套实验装置中能防止倒吸的装置有III和IV(填装置序号).
(3)反应结束后,开启K2,关闭K1和分液漏斗活塞,使装置I中的水倒吸入装置Ⅱ中,这样操作的目的是反应结束后装置II中存在大量的溴化氢,使I的水倒吸入II中可以除去溴化氢气体,以免逸出污染空气.
(4)反应结束后,为了得到较纯净的溴苯,对Ⅱ中的溶液按下列步骤分离提纯:
①依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是:除去溴苯中溶有的HBr和Br2
②洗涤后再干燥,即得到粗溴苯,此粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母):
A、重结晶 B、过滤 C、蒸馏 D、萃取
(5)此装置是否能判断苯与溴发生的是取代反应:是,Ⅲ中的广口瓶中出现淡黄色沉淀
(填“是”则写出能说明发生的是取代反应的现象,填“否”则解释其原因.)
19.在通常条件下,下列各组物质的性质排列正确的是( )
| A. | 热稳定性:HF>H2O>NH3 | B. | 原子半径:F>O>N | ||
| C. | 沸点:乙烷>戊烷>丁烷 | D. | 酸性:H2SO4>H3PO4>HClO4 |
 、
、 .
.