题目内容
HA为酸性略强于醋酸的一元弱酸.在0.1mol?L-1 NaA溶液中,离子浓度关系正确的是( )
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)>c(OH-)>c(A-)>c(H+) |
| C、c(Na+)+c(OH-)=c(A-)+c(H+) |
| D、c(Na+)+c(H+)=c(A-)+c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:HA为酸性略强于醋酸的一元弱酸,NaA为强碱弱酸盐,A-水解导致溶液呈碱性,溶液中存在电荷守恒和物料守恒.
解答:
解:A.NaA为强碱弱酸盐,A-水解导致溶液呈碱性,则c(H+)<c(OH-),A-水解、钠离子不水解,所以c(Na+)>c(A-),A-水解程度较小,则溶液中离子浓度大小顺序是c(Na+)>c(A-)>c(OH-)>c(H+),故A错误;
B.根据A知,c(OH-)<c(A-),故B错误;
C.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),溶液呈碱性,钠离子不水解,所以c(Na+)+c(OH-)>c(A-)+c(H+),故C错误;
D.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),故D正确;
故选D.
B.根据A知,c(OH-)<c(A-),故B错误;
C.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),溶液呈碱性,钠离子不水解,所以c(Na+)+c(OH-)>c(A-)+c(H+),故C错误;
D.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),故D正确;
故选D.
点评:本题考查了离子浓度大小比较,明确盐的特点结合“谁强谁显性、谁弱谁水解”来分析解答,注意守恒思想的运用,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
对于反应8NH3+3Cl2═6NH4Cl+N2,下列分析正确的是( )
| A、Cl2为还原剂 |
| B、NH4Cl为氧化产物 |
| C、常温常压下有2.24LN2生成时转移0.6mol电子 |
| D、有2molNH3被氧化就有8molNH3参加反应 |
今有pH=10的Na2CO3溶液、pH=10的NaOH溶液和pH=4的CH3COOH溶液.若上述三种溶液中水的电离度分别为α1、α2、α3,下列关系正确的是( )
| A、α1=α2=α3 |
| B、α1>α2>α3 |
| C、α1>α2=α3 |
| D、α1=α2<α3 |
下列各组中的两个反应,可用同一离子方程式表示的是( )
| A、CaCO3和HCl、Na2CO3和HCl |
| B、BaCl2和H2SO4、Ba(OH)2和H2SO4 |
| C、HNO3和K2CO3、HCl和NaHCO3 |
| D、KOH和H2SO4、Ba(OH)2和HNO3 |
下列说法正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、放热反应在常温下一定很容易发生 |
| C、化学反应除了生成新的物质外,还伴随着能量的变化 |
| D、吸热反应不加热就不会发生 |




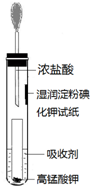 氯气是一种常用的自来水消毒剂.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是一种常用的自来水消毒剂.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答: