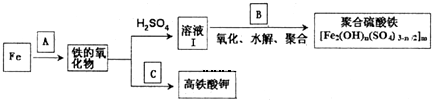
题目内容
14.完成方程式,写出反应类型【有机物必须写结构简式.需注明必要的反应条件】
(1)CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl 类型取代反应
(2)CH4$\stackrel{高温}{→}$C+2H2 类型分解反应.
分析 甲烷为饱和烃,可发生取代反应,乙烯含有碳碳双键,乙炔含有碳碳三键,可发生加成、加聚和氧化反应,以此解答该题.
解答 解:(1)甲烷在光照条件下可与氯气发生取代反应生成一氯甲烷,方程式为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;取代反应;
(2)在高温条件下,甲烷可分解生成炭黑和氢气,方程式为CH4$\stackrel{高温}{→}$C+2H2,故答案为:CH4$\stackrel{高温}{→}$C+2H2;分解反应.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构以及官能团的性质,把握反应的条件和类型的判断,难度不大.

练习册系列答案
相关题目
5.下列物质中属于盐的是( )
| A. | MgO | B. | H2SO4 | C. | NaOH | D. | KNO3 |
2.下列离子方程式正确的是( )
| A. | 将氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 硫酸溶液与氯化钡溶液混合:Ba2++SO42-═BaSO4↓ |
19.下列叙述正确的是( )
| A. | 0.5mol•L-1CuCl2溶液含有3.01×1023个Cu2+ | |
| B. | 28g聚乙烯分子含有的碳原子数为 NA | |
| C. | 0.2mol PCl5分子中,键数目为NA | |
| D. | 标准状况下,3.36L H2O含有9.03×1023个H2O分子 |
1.有A、B、C、D、E、F、G七瓶不同物质的溶液,它们各是K2CO3、Na2SO4、NaCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种.为了鉴别,各取少量溶液进行两两混合,实验结果如表所示.表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显变化.试回答下面问题:
(1)A的化学式是NaCl?,D的化学式是?K2CO3,F的化学式是?Ba(OH)2,判断A理由是相互混合时A只与G反应生成沉淀,生成的沉淀为AgCl.
(2)写出B和E反应的离子反应方程式?Ca2++SO42-=CaSO4↓.
| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | - | ↓ | ↓ | ↓ |
| C | - | - | - | ↓ | ↓ | ↓ | |
| D | - | ↓ | - | ↓ | ↓ | ↓ | |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
(2)写出B和E反应的离子反应方程式?Ca2++SO42-=CaSO4↓.
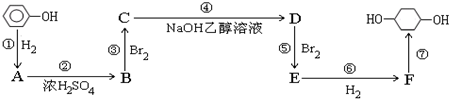
 ,F
,F ;A含有的官能团名称是羟基;
;A含有的官能团名称是羟基; ;
;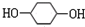 +2NaBr.
+2NaBr.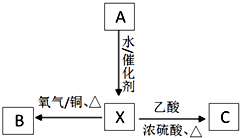 A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答:
A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答: