题目内容
科学地补充碘可防止碘缺乏病.
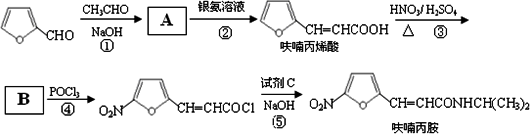
(1)如图1为海带制碘的流程图.步骤③的实验操作中用到的玻璃仪器除了烧杯、玻璃棒之外还有 ;当步骤④反应中转移0.2mol的电子时生成碘的质量: .
(2)碘酸钾(KIO3)是食盐的加碘剂.KIO3在酸性介质中能与H2O2或Iˉ作用均生成单质碘.
请回答下列问题:
①以碘为原料,通过电解制备碘酸钾的实验装置如图2所示.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区.
电解时,阳极反应:I-+6OH--6e-═IO3-+3H2O,当外电路上通过3mol电子时(碘离子被完全消耗),溶液中IO3-的物质的量是 ;阴极上产生的气体在标准状况下的体积: .
②电解过程中,需通过检验阳极电解液中是否有Iˉ存在以确定电解是否完成.请设计判断电解是否完成的实验方案,并填入表中.仪器不限、可选的试剂:淀粉溶液、H2O2溶液、稀硫酸.

(1)如图1为海带制碘的流程图.步骤③的实验操作中用到的玻璃仪器除了烧杯、玻璃棒之外还有
(2)碘酸钾(KIO3)是食盐的加碘剂.KIO3在酸性介质中能与H2O2或Iˉ作用均生成单质碘.
请回答下列问题:
①以碘为原料,通过电解制备碘酸钾的实验装置如图2所示.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区.
电解时,阳极反应:I-+6OH--6e-═IO3-+3H2O,当外电路上通过3mol电子时(碘离子被完全消耗),溶液中IO3-的物质的量是
②电解过程中,需通过检验阳极电解液中是否有Iˉ存在以确定电解是否完成.请设计判断电解是否完成的实验方案,并填入表中.仪器不限、可选的试剂:淀粉溶液、H2O2溶液、稀硫酸.
| 实验操作 | 实验现象及结论 |
考点:海带成分中碘的检验,电解原理,物质检验实验方案的设计
专题:
分析:(1)步骤③是过滤,第④步发生的反应为2I-+MnO2+4H++=I2+Mn2++2H2O;
(2)①IO3-的来源为两部分,①3I2+6KOH=5KI+KIO3+3H2O,②I-+6OH--6e-=IO3-+3H2O;
②酸性条件下,碘离子和碘酸根离子能发生氧化还原反应生成碘单质,淀粉遇碘变蓝色,根据溶液是否变蓝判断是否含有碘离子.
(2)①IO3-的来源为两部分,①3I2+6KOH=5KI+KIO3+3H2O,②I-+6OH--6e-=IO3-+3H2O;
②酸性条件下,碘离子和碘酸根离子能发生氧化还原反应生成碘单质,淀粉遇碘变蓝色,根据溶液是否变蓝判断是否含有碘离子.
解答:
解:(1)从悬浊液中分离,采用过滤的方法,需要使用烧杯、玻璃棒之外还有漏斗;
第④步发生的反应为2I-+MnO2+4H++=I2+Mn2++2H2O,方程式中转移2mol电子,转移0.2mol的电子时生成碘0.1mol,质量为25.4 g,故答案为:漏斗;25.4 g;
(2)①IO3-的来源为两部分,①3I2+6KOH=5KI+KIO3+3H2O,②I-+6OH--6e-=IO3-+3H2O,通过3mol电子时,总量为0.1+0.5=0.6mol;
阴极发生反应为2H++2e-=H2,
通过3mol电子时,产生标况下H233.6L,
故答案为:0.6mol;33.6 L;
②电解后的溶液区含有碘酸根离子,酸性条件下,碘离子和碘酸根离子能发生氧化还原反应生成碘单质,淀粉溶液遇碘变蓝色,所以实验方法是:取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉溶液,观察是否变蓝;如果阳极区含有碘离子,加入稀硫酸后就有碘单质生成,淀粉溶液就会变蓝色,否则不变色,
故答案为:取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉试液,观察是否变蓝;如果不变蓝,说明无I-(如果变蓝,说明有I-).
第④步发生的反应为2I-+MnO2+4H++=I2+Mn2++2H2O,方程式中转移2mol电子,转移0.2mol的电子时生成碘0.1mol,质量为25.4 g,故答案为:漏斗;25.4 g;
(2)①IO3-的来源为两部分,①3I2+6KOH=5KI+KIO3+3H2O,②I-+6OH--6e-=IO3-+3H2O,通过3mol电子时,总量为0.1+0.5=0.6mol;
阴极发生反应为2H++2e-=H2,
通过3mol电子时,产生标况下H233.6L,
故答案为:0.6mol;33.6 L;
②电解后的溶液区含有碘酸根离子,酸性条件下,碘离子和碘酸根离子能发生氧化还原反应生成碘单质,淀粉溶液遇碘变蓝色,所以实验方法是:取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉溶液,观察是否变蓝;如果阳极区含有碘离子,加入稀硫酸后就有碘单质生成,淀粉溶液就会变蓝色,否则不变色,
故答案为:取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉试液,观察是否变蓝;如果不变蓝,说明无I-(如果变蓝,说明有I-).
点评:本题考查较为综合,涉及电解原理、碘离子的检验等性质,难度不大,明确酸性条件下碘离子和碘酸根离子能生成碘单质,碱性条件下,碘能和氢氧根离子生成碘离子和碘酸根离子.

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
实验测得甲烷的燃烧热(△H=-890.3KJ/mol).则下列表示甲烷燃烧热的热化学方程式正确的是( )
| A、CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ/mol | ||||
| B、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3KJ/mol | ||||
C、
| ||||
D、
|
下列说法正确的是( )
| A、甲烷是最简单的烃,也是含H的质量分数最大的烃 |
| B、通式相同、组成上相差一个或若干个“CH2”原子团的化合物,一定互为同系物 |
| C、有机物一定含C和H两种元素,可能含有O元素 |
| D、含有5个碳原子的有机物,每个分子中最多可形成4个C-C单键 |
131 53 |
131 53 |
| A、质量数为131 |
| B、中子数为53 |
| C、质子数为78 |
| D、核外电子数为131 |
如图所示,若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂不可能是 ( )
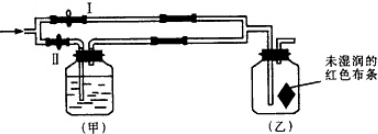

| A、浓H2SO4 |
| B、NaCl溶液 |
| C、Ba(OH)2溶液 |
| D、NaOH溶液 |
 如图所示,甲是刚浸过的NaCl溶液的石蕊试纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发现AB两极间的紫红色圆点向A极移动了一段距离,则与A相连的是电源的
如图所示,甲是刚浸过的NaCl溶液的石蕊试纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发现AB两极间的紫红色圆点向A极移动了一段距离,则与A相连的是电源的