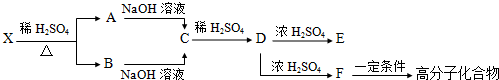
题目内容
用双线桥标出以下方程式中元素化合价变化、电子转移及数目并指出氧化剂还原剂.
(1)4Al+3O2═2Al2O3
(2)2H2O2═2H2O+O2↑
(1)4Al+3O2═2Al2O3
(2)2H2O2═2H2O+O2↑
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)该反应中Al元素化合价由0价变为+3价、O元素化合价由0价变为2价,得失电子最小公倍数是12;
(2)该反应中O元素化合价由-1价变为0价和-2价,得失电子最小公倍数是2.
(2)该反应中O元素化合价由-1价变为0价和-2价,得失电子最小公倍数是2.
解答:
解:(1)该反应中Al元素化合价由0价变为+3价、O元素化合价由0价变为2价,得失电子最小公倍数是12,其转移电子方向和数目为 ,故答案为:
,故答案为: ;
;
(2)该反应中O元素化合价由-1价变为0价和-2价,得失电子最小公倍数是2,其转移电子方向和数目为 ,故答案为:
,故答案为: .
.
 ,故答案为:
,故答案为: ;
;(2)该反应中O元素化合价由-1价变为0价和-2价,得失电子最小公倍数是2,其转移电子方向和数目为
 ,故答案为:
,故答案为: .
.
点评:本题考查了氧化还原反应,根据元素化合价升降计算其转移电子数,会正确标出电子转移方向和数目,为难点.

练习册系列答案
相关题目
常温下,0.01mol?L-1 MOH溶液的pH为10.已知:
2MOH(aq)+H2SO4(aq)═M2SO4(aq)+2H2O(l)△H1=-24.2kJ?mol-1;
H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ?mol-1
则MOH在水溶液中电离的△H为( )
2MOH(aq)+H2SO4(aq)═M2SO4(aq)+2H2O(l)△H1=-24.2kJ?mol-1;
H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ?mol-1
则MOH在水溶液中电离的△H为( )
| A、+33.1kJ?mol-1 |
| B、+45.2kJ?mol-1 |
| C、-81.5kJ?mol-1 |
| D、-33.1kJ?mol-1 |
将0.5mol Na投入过量的水(m1g)中,得到a g溶液;将0.5mol Zn投入过量的盐酸(m2g)中,得到bg溶液,若m1═m2,则a.b的质量关系是( )
| A、a>b | B、a<b |
| C、a=b | D、不能确定 |
在密闭容器中,一定量混合气体发生下列反应:aM(g)+bN(g)?cW(g),达一平衡后,测得M气体的浓度为0.5mol/L.当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L.则下列叙述正确的是( )
| A、W的体积分数降低 |
| B、平衡向右移动 |
| C、N的转化率提高 |
| D、反应速率增大 |