题目内容
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1 mol氯气参加氧化还原反应,转移的电子数一定为2NA |
| B、标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA |
| C、含1 mol FeCl3的溶液中Fe3+的个数为NA |
| D、1.8 g NH4+中含有的电子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,1mol氯气完全反应转移了1mol电子;
B.1mol氢气和1mol一氧化碳分别与氧气反应,都消耗了0.5mol氧气,据此计算出标况下8.96L氢气和CO混合气体完全燃烧消耗氧气的物质的量及分子数;
C.氯化铁溶液中,铁离子部分水解,导致溶液中铁离子数目减少;
D.铵根离子中含有10个电子,0.1mol铵根离子中含有1mol电子.
B.1mol氢气和1mol一氧化碳分别与氧气反应,都消耗了0.5mol氧气,据此计算出标况下8.96L氢气和CO混合气体完全燃烧消耗氧气的物质的量及分子数;
C.氯化铁溶液中,铁离子部分水解,导致溶液中铁离子数目减少;
D.铵根离子中含有10个电子,0.1mol铵根离子中含有1mol电子.
解答:
解:A.1mol氯气参加的氧化还原反应,转移的电子不一定为2mol,如常温下氯气与氢氧化钠溶液反应中,1mol氯气完全反应转移了1mol电子,故A错误;
B.标况下8.96L氢气和一氧化碳的混合气体的物质的量为0.4mol,0.4mol混合气体完全燃烧消耗氧气的物质的量为0.2mol,消耗氧气的分子数为0.2NA,故B正确;
C.1 mol FeCl3的溶液中,由于铁离子部分水解,则溶液中铁离子小于1mol,Fe3+的个数小于NA,故C错误;
D.1.8g铵根离子的物质的量为0.1mol,0.1mol铵根离子中含有1mol电子,含有的电子数为NA,故D错误;
故选B.
B.标况下8.96L氢气和一氧化碳的混合气体的物质的量为0.4mol,0.4mol混合气体完全燃烧消耗氧气的物质的量为0.2mol,消耗氧气的分子数为0.2NA,故B正确;
C.1 mol FeCl3的溶液中,由于铁离子部分水解,则溶液中铁离子小于1mol,Fe3+的个数小于NA,故C错误;
D.1.8g铵根离子的物质的量为0.1mol,0.1mol铵根离子中含有1mol电子,含有的电子数为NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确氯气参加的氧化还原反应中,氯气与金属反应,1mol氯气完全反应转移了2mol电子,氯气与水、氢氧化钠溶液的反应中,1mol氯气完全反应转移了1mol电子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将1.12g铁粉加入25mL 2mol/L的FeCl3溶液中,充分反应后,其结果是( )
| A、氧化产物和还原产物的物质的量之比为2:5 |
| B、Fe2+和Fe3+物质的量之比为6:1 |
| C、铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 |
| D、往溶液中滴入无色KSCN溶液,不显红色 |
“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应.其供电原理是:白天太阳能帆板发电,将一部分电量直接供给天宫一号,另一部分电量储存在镍氢电池里,供黑夜时使用.镍氢电池放电时的总反应为:MH+NiO(OH)═M+Ni(OH)2(M为氢化物电极的储氢金属,也可看作H2直接参加反应).下列说法正确的是( )
| A、充电时阴极区电解质溶液pH减小 |
| B、在使用过程中此电池要不断补充水 |
| C、放电时NiO(OH)在电极上发生氧化反应 |
| D、充电时阳极反应为Ni(OH)2-e-+OH-═NiO(OH)+H2O |
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是( )
| A、糖类是热值最高的营养物质 |
| B、蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
| C、油脂是油和脂肪的统称,油脂属于酯类 |
| D、在蛋白质溶液中加入饱和硫酸铵溶液,析出的蛋白质再加水也不溶解 |
配制100mL 0.1mol?L-1 Na2CO3溶液,下列操作正确的是( )
| A、称取1.06 g 无水碳酸钠,加入100 mL 容量瓶中,加水溶解、定容 |
| B、称取1.06 g 无水碳酸钠,加入蒸馏水,搅拌、溶解,配制100 mL溶液 |
| C、转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 |
| D、定容后,塞好瓶塞,反复倒转,摇匀 |
T℃时在2L密闭容器中使x(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2(T2>T1)时,Y的体积分数(或Y的物质的量分数)与时间的关系如图2所示.则下列结论正确的是( )
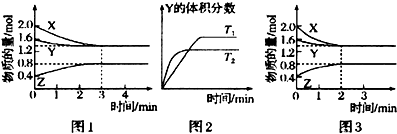

| A、容器中发生的反应可表示为:4X(g)+Y(g)═2Z(g) |
| B、反应进行的前3min内,用x表示的反应速率V(X)=0.3mol/(L?min) |
| C、升高温度,反应的化学平衡常数K增大 |
| D、若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
下列溶液中有关微粒的物质的量浓度的比较正确的是( )
| A、常温下的两种溶液:①0.1 mol?L-1 CH3COOH溶液;②0.3 mol?L-1 CH3COOH与0.1 mol?L-1NaOH两溶液等体积混合后,c(H+):①<② |
| B、已知NaHSO3溶液的pH<7,则该溶液中:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
| C、相同条件下,pH=9的 ①CH3COONa溶液;②NH3?H2O溶液;③NaOH溶液中,由水电离出的c(OH-):①>②>③ |
| D、等物质的量浓度的CH3COONa与CH3COOH的混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) |
下列各组离子能在酸性的无色溶液中大量共存的是( )
| A、K+、Cl-、HCO3-、SO42- |
| B、Mg2+、Cl-、Al3+、SO42- |
| C、Ca2+、Fe3+、Na+、NO3- |
| D、Ba2+、Cl-、Na+、CO32- |
下列关于胶体的叙述正确的是( )
| A、溶液是电中性的,胶体是带电的 |
| B、可以用渗析的方法将胶体与溶液分离 |
| C、胶体中的分散质粒子大小在1~10nm之间 |
| D、向煮沸的稀氢氧化钠溶液中滴加饱和和FeC13溶液配制Fe(OH)3胶体 |