题目内容
6.下列反应既属于离子反应,又属于氧化还原反应的是( )| A. | Zn与稀硫酸的反应 | B. | 分解氯酸钾制氧气 | ||
| C. | NaOH溶液与盐酸中和 | D. | MgCl2溶液与KOH溶液产生沉淀 |
分析 氧化还原反应的特征是元素化合价的升降,可从元素化合价是否发生变化的角度判断是否氧化还原反应,离子反应一般在溶液中进行,且有离子参加,以此进行解答.
解答 解:A.反应在溶液中进行,属于离子反应,Zn和H元素的化合价发生变化,属于氧化还原反应,故A正确;
B.分解氯酸钾制氧气的反应为氧化还原反应,但不是离子反应,故B错误;
C.NaOH溶液与盐酸中和中,元素化合价没有发生变化,不是氧化还原反应,故C错误;
D.元素化合价没有发生变化,不是氧化还原反应,故D错误;
故选A.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意把握常见反应类型的特点及判断,明确氧化还原反应的特征为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
9.下列各对原子序数的原子能以共价键结合成化合物的是( )
| A. | 9和11 | B. | 6和1 | C. | 11和1 | D. | 12和17 |
11.下列有关化学用语正确的是( )
| A. | C原子结构示意图: | |
| B. | 白磷的分子式:P | |
| C. | 含有七个中子的碳原子的核组成符号:${\;}_{12}^{6}$C | |
| D. | 次氯酸的结构式为:H-Cl-O |
18.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 1.8g18O2分子与1.8g18O3分子中含有的中子数不同 | |
| B. | 7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA | |
| C. | 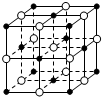 23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元 | |
| D. | 含16 g氧原子的二氧化硅晶体中含有的δ键数目为NA |
15.常温下,下列各组离子在指定环境下能大量共存的是( )
| A. | 碱性溶液中Na+、Cu2+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$ | |
| B. | 中性溶液中Na+、Fe3+、OH-、SO${\;}_{4}^{2-}$ | |
| C. | 碱性溶液中Na+、K+、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$ | |
| D. | 酸性溶液中Na+、K+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ |
16.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
① ②NaHCO3 ③Al ④
②NaHCO3 ③Al ④ ⑤Al2(SO4)3.
⑤Al2(SO4)3.
①
 ②NaHCO3 ③Al ④
②NaHCO3 ③Al ④ ⑤Al2(SO4)3.
⑤Al2(SO4)3.| A. | ①③ | B. | ③⑤ | C. | ①②③ | D. | ①③④ |
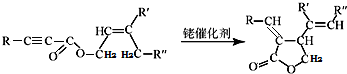
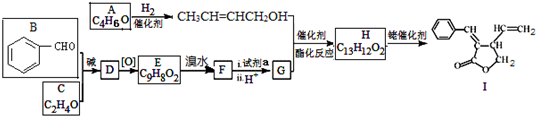
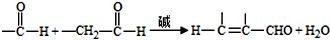
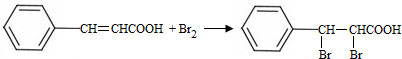 ;试剂a 是NaOH、醇溶液.
;试剂a 是NaOH、醇溶液.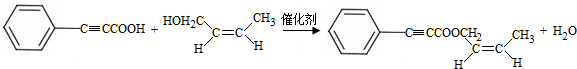 .
.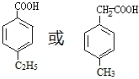 (写出一种即可).
(写出一种即可). 和CH3CHO为原料合成
和CH3CHO为原料合成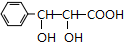 的合成路线流程图:
的合成路线流程图: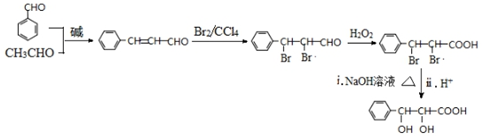 .(其它试剂任选,合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
.(其它试剂任选,合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)