题目内容
12.非金属单质A,经如图所示的过程转化为含氧酸D,已知D为常见强酸
请回答下列问题:
(1)若A常温下为固体,B是能使品红溶液褪色的无色气体
①A的化学式是S,
②在工业生产中B气体的大量排放被雨水吸收后形成了酸雨而污染环境.
③请写出单质铜与D的浓溶液反应的化学方程式:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2 H2O,
其中铜元素被氧化(填“氧化”或“还原”),在该反应中,若消耗了0.5mol Cu,则标准状况下生成气体的体积约为11.2L.
(2)若A在常温下为气体,C是红棕色气体
①B的化学式是NO,
②写出C→D反应的化学方程式3NO2+H2O=2HNO3+NO.
分析 非金属单质A能发生连续氧化,且最终得含氧酸D为强酸,中学中硫和氮元素化合物符合转化关系.
(1)A在常温下为固体,B是能使品红溶液褪色的无色气体,则A为S元素,B为SO2,C为SO3,D为H2SO4;
(2)若A在常温下为气态化合物,C是红棕色的气体,则A应为NH3,B为NO,C为NO2,D为HNO3.
解答 解:非金属单质A能发生连续氧化,且最终得含氧酸D为强酸,中学中硫和氮元素化合物符合转化关系.
(1)A在常温下为固体,B是能使品红溶液褪色的无色气体,则A为S元素,B为SO2,C为SO3,D为H2SO4.
①A的化学式为S,故答案为:S;
②在工业生产中SO2气体的大量排放被雨水吸收后形成了酸雨而污染了环境,故答案为:酸雨;
③单质铜与D的浓溶液反应的化学方程式Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2 H2O,其中铜元素化合价升高,被氧化,在该反应中,若消耗了0.5mol Cu,生成0.5molSO2,标准状况下生成气体的体积约为 0.5mol×22.4L/mol=11.2L,
故答案为:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2 H2O;氧化;11.2;
(2)若A在常温下为气态化合物,C是红棕色的气体,则A应为NH3,B为NO,C为NO2,D为HNO3.
①B的化学式是NO,故答案为:NO;
②C→D反应的化学方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO.
点评 本题考查无机物的推断,基本属于开放性题目,物质的颜色以及连续发生氧化反应为突破口进行推断,熟练掌握中学常见连续反应.

 阅读快车系列答案
阅读快车系列答案| A. | 150 mL 1mol/L的NaClO | B. | 150 mL 3 mol/L的KCl | ||
| C. | 75mL 2 mol/L的NH4Cl | D. | 75 mL 2 mol/L的CaCl2 |
| A. | 氯气用于制备漂白粉 | B. | 单质硅用于制造光导纤维 | ||
| C. | 用明矾净化水 | D. | 燃煤时加入石灰石减少SO2排放 |
| A. | Na与氧气 | B. | 澄清石灰水与二氧化碳 | ||
| C. | 氯化铝溶液与氢氧化钠溶液 | D. | Al与稀盐酸 |
| A. | 32g氧气和臭氧的混合气体中所含的原子数为2NA | |
| B. | 常温常压下,22.4LCO2含有的分子数目为NA | |
| C. | 2.4g金属镁与足量的盐酸反应,转移的电子数为0.2NA | |
| D. | 0.1mol OH-含有NA个电子 |
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+ | |
| B. | 上述实验中,有一个氧化还原反应 | |
| C. | 实验①生成的气体需要进行尾气处理 | |
| D. | 实验②证明Fe2+既有氧化性又有还原性 |
| A. | 同位素:14C与14N | |
| B. | 同系物:丙烷、异丁烷、新戊烷 | |
| C. | 电解质:冰醋酸、水银、烧碱 | |
| D. | 酸性氧化物:一氧化氮﹑二氧化碳、三氧化硫 |
| A. | 过氧化钠的化学式:Na2O | |
| B. | 氯化钙化学式:CaCl | |
| C. | 铝的原子结构示意图: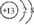 | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO42- |
| A. | 白醋中滴入石蕊试液呈红色 | B. | 白醋加入豆浆中有沉淀产生 | ||
| C. | pH 试纸显示白醋的 pH 为 2~3 | D. | 蛋壳浸泡在白醋中有气体放出 |