题目内容
8.黑火药是我国古代四大发明之一,其爆炸时发生反应的化学方程式为:S+2KNO3+3C=K2S+N2↑+3CO2↑.设该反应中转移的电子数为amol,被2molKNO3氧化而成的氧化产物为bmol,则a、b的值分别为( )| A. | 12,2.5 | B. | 24,2.5 | C. | 12,3.0 | D. | 24,3.0 |
分析 反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N、S元素的化合价降低,C元素的化合价升高,依据氧化剂与还原剂得失电子数守恒计算2mol KNO3可氧化的C的物质的量.
解答 解:在反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N元素的化合价由+5降低为0,S元素的化合价由0降低为-2价,则KNO3和S作氧化剂,C由0价升高为+4价,做还原剂,根据反应可知,3molC完全被氧化化合价升高:3mol×4=12mol;
2mol KNO3得到电子为:2mol×5=10mol,设能够氧化碳的物质的量为xmol,则依据得失电子守恒得:10mol=x×4,解得:x=2.5,
故选A.
点评 本题考查了氧化还原反应的计算,题目难度不大,明确氧化还原反应的实质与特征为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
19.在容积相同的A、B两个密闭容器中,分别充入amolN2和bmolH2,使它们在同温度下反应,并达到平衡,若A容器保持体积不变,B容器保持压强不变,当A中NH3的体积分数为25%时,则B中NH3的体积分数为( )
| A. | 12.5% | B. | 25% | C. | <25% | D. | >25% |
16.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 18gC含有9NA个电子 | |
| B. | 标准状况下22.4LCCl4含有4NA个氯原子 | |
| C. | 标准状况下,33.6LN2和H2的混合气体中含3NA个原子 | |
| D. | 2.709×1024个原子的水分子含有1.5NA个氧原子 |
7.合金具有许多优良的性能.下列物质属于合金的是( )
| A. | 黄铜 | B. | 硫酸铜 | C. | 镁 | D. | 氧化铝 |
8.下列说法正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| C. | 1 mol-CH3 含有9 mol 电子 | |
| D. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 |
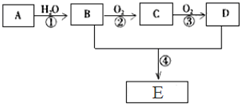 已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.