题目内容
9.某小组同学研究合成氨反应及氨水的性质如下:(1)已知:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则氨气完全燃烧生成氮气和水蒸气的热化学方程式4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266kJ/mol.
(2)图1是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表
温度或压强.其中X代表的是压强(填“温度”或“压强”),判断L1、L2的大小关系并说明理由L1<L2因为合成氨的反应是放热反应,压强相同时,温度升高,平衡逆向移动,氨的体积分数减小.
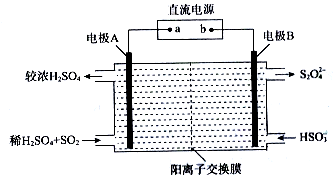
(3)已知:在硫酸铜溶液中加入浓氨水,首先析出蓝色的碱式硫酸铜沉淀,氨水过量时此沉淀溶解,得到深蓝色的四氨合铜(Ⅱ)络离子,发生的离子反应如下:
a.2Cu2++2NH3•H2O+SO42-═2NH4++Cu2(OH)2SO4↓
b.Cu2(OH)2SO4+8NH3?2[Cu(NH3)4]2++SO42-+2OH-
某小组设计如图2实验:

①试管ⅰ中反应的离子方程式[Cu(NH3)4]2++S2-═CuS↓+4NH3↑.
②试管ⅱ中的深蓝色晶体是[Cu(NH3)4]SO4•H2O,该晶体的性质是在乙醇中溶解度比在水中溶解度较小.
③请结合方程式解释试管ⅲ加入少量NaOH后,产生蓝色沉淀和气体的原因[Cu(NH3)4]2++2OH-═Cu(OH)2↓+4NH3↑,向其中加入NaOH,使c(OH-)浓度增大,故平衡逆向移动,析出蓝色沉淀并生成气体.
分析 (1)根据盖斯定律结合热化学方程式的书写方法来书写即可;
(2)升高温度,平衡向吸热的方向移动;增大压强,平衡向气体体积缩小的方向移动;
(3)①结合图二分析[Cu(NH3)4](OH)2和Na2S反应生成黑色CuS和NH3;
②结合络合物在乙醇中溶解度较小,所以会析出分析;
③结合此方程式[Cu(NH3)4]2++2 OH-═Cu(OH)2↓+4 NH3↑,并从影响平衡移动的因素分析.
解答 解:(1)已知:①N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
根据盖斯定律,反应4NH3(g)+3O2(g)═2N2(g)+6H2O(g)可以由②×3-①×2得到,所以该反应焓变△H=-1266 kJ/mol,
故答案为:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266 kJ/mol;
(2)N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1为放热反应,若升高温度平衡逆向移动,前期的体积分数减小,与图象矛盾,若增大压强,平衡向正向移动,氨气的体积分数增大,故改变条件为压强;压强相同时,温度升高,平衡逆向移动,氨的体积分数减小,L1<L2,
故答案为:压强;L1<L2因为合成氨的反应是放热反应,压强相同时,温度升高,平衡逆向移动,氨的体积分数减小;
(3)①结合图二分析[Cu(NH3)4](OH)2和Na2S反应生成黑色CuS和NH3,故方程式为[Cu(NH3)4](OH)2+Na2S=CuS↓+4NH3↑+2NaOH,并据强酸,强碱,大多数盐拆等,故离子方程式为[Cu(NH3)4]2++S2-═CuS↓+4 NH3↑,
故答案为:[Cu(NH3)4]2++S2-═CuS↓+4 NH3↑;
②[Cu(NH3)4]SO4•H2O该晶体是络合物,故在乙醇中溶解度比在水中溶解度较小,
故答案为:在乙醇中溶解度比在水中溶解度较小;
③试管ⅲ加入少量NaOH后,产生蓝色沉淀和气体的原因是因为[Cu(NH3)4]2++2 OH-═Cu(OH)2↓+4 NH3↑,向其中加入NaOH,使c(OH-)浓度增大,故平衡逆向移动,析出蓝色沉淀并生成气体,
故答案为:[Cu(NH3)4]2++2 OH-═Cu(OH)2↓+4 NH3↑,向其中加入NaOH,使c(OH-)浓度增大,故平衡逆向移动,析出蓝色沉淀并生成气体.
点评 本题考查了热化学方程式的书写、化学平衡影响因素、络合物的性质等,主要是反应能量变化的计算,解决本题要求学生需有扎实的基础,试题难度中等.

| A. | Sr为于第4周期ⅡA 族 | |
| B. | ${\;}_{38}^{90}$Sr核内中子数与质子数之差为14 | |
| C. | ${\;}_{38}^{90}$Sr与${\;}_{39}^{90}$Y互为同位素 | |
| D. | ${\;}_{38}^{90}$Sr的核内质子数为38,Sr元素的相对原子质量为90 |
| A. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| B. | 用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| D. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 |
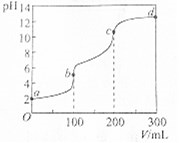 室温下,向100mL一定浓度的草酸(H2C2O4)溶液中加入0.1mol•L-1 NaOH溶液的pH随NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
室温下,向100mL一定浓度的草酸(H2C2O4)溶液中加入0.1mol•L-1 NaOH溶液的pH随NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )| A. | a点溶液的pH=2,草酸溶液的浓度为0.005mol•L-1 | |
| B. | b点对应溶液中:c(Na+)>c(HC2O4-)>c(OH-)>c(C2O42-) | |
| C. | b→c段,反应的离子方程式为HC2O4-+OH-═C2O42-+H2O | |
| D. | c→d段,溶液中C2O42-的水解程度逐渐增强 |
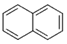 ,
,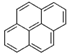 ,
,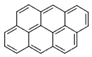 ,…若用分子式表示这一系列化合物,其第十五项应为( )
,…若用分子式表示这一系列化合物,其第十五项应为( )| A. | C15H24 | B. | C94H36 | C. | C60H36 | D. | C34H96 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.