题目内容
20.现有6种物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥酒精. 请用序号回答下列问题:(1)属于强电解质的是①⑤;
(2)属于弱电解质的是③;
(3)属于非电解质的是②⑥.
分析 电解质是指在水溶液里或熔融状态下能导电的化合物,包括酸、碱、盐、活泼金属氧化物和水;
能够完全电离的电解质是强电解质;
只能部分电离的电解质是弱电解质;
非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
解答 解:①NaCl晶体在水溶液里或熔融状态下能完全电离出自由离子而导电,属于强电解质;
②液态SO3本身不能电离,是化合物,属于非电解质;
③液态的醋酸在水溶液里只能部分电离出自由离子而导电,属于弱电解质;
④汞是单质,既不是电解质,也不是非电解质;
⑤BaSO4固体在水溶液里或熔融状态下能完全电离出自由离子而导电,属于强电解质;
⑥酒精在水溶液里和熔融状态下都不能导电的化合物,属于非电解质;
所以:1)属于强电解质的是①⑤;
(2)属于弱电解质的是③;
(3)属于非电解质的是②⑥;
故答案为:(1)①⑤; (2)③; (3)②⑥.
点评 本题考查了电解质、非电解质、强电解质、弱电解质的判断,熟悉相关概念是解题关键,注意电解质强弱与电离程度有关,与溶解性无关,题目难度不大.

练习册系列答案
相关题目
11.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n,下列说法错误的是( )
| A. | 若8>m>3,则X必定为主族元素 | |
| B. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为极性分子 | |
| C. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X | |
| D. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y |
8.下列有关物质的性质及应用说法正确的是( )
| A. | 干燥的Cl2和氯水均能使鲜花褪色 | |
| B. | SiO2具有导电性,可用于制造半导体材料 | |
| C. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ | |
| D. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
15.量取25.00mL硫酸溶液,可选用的仪器是( )
| A. | 50mL量筒 | B. | 25mL量筒 | C. | 50mL碱式滴定管 | D. | 50mL酸式滴定管 |
12. 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列有关实验的说法不合理的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列有关实验的说法不合理的是( )
 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列有关实验的说法不合理的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列有关实验的说法不合理的是( )| A. | 反应一段时间,①中试管底部有少量固体生成 | |
| B. | ②中用品红溶液验证SO2的生成 | |
| C. | ③中用石蕊溶液检验SO2溶液的酸碱性 | |
| D. | 向①中直接加水,观察颜色,确认CuSO4生成 |
9.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| B. | 2mol/L的硫酸溶液中含有的H+离子数为4NA | |
| C. | 1mol 氯气与足量的铁反应后转移的电子数为3NA | |
| D. | 密闭容器中1molN2与3molH2在铂催化下充分反应,产物的分子数为2NA |
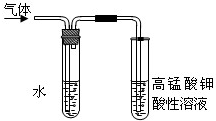 实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:
实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:


