题目内容
某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20min时间内平均速率为 mol?(L?min)-1.
(2)在实验2中A的初始浓度C2= mol?L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是 .
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1?(填“>”“=”或“<”=,且C3 1.0mol?L-1(填“>”“=”或“<”).
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20min时间内平均速率为
(2)在实验2中A的初始浓度C2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
考点:探究影响化学反应速率的因素
专题:实验设计题
分析:(1)根据平均化学反应速率公式:v=
计算;
(2)根据实验1、2数据、利用影响速率的因素来分析;
(3)根据浓度对化学反应速率的影响分析;利用相同温度下平衡常数不变进行计算.
| △c |
| △t |
(2)根据实验1、2数据、利用影响速率的因素来分析;
(3)根据浓度对化学反应速率的影响分析;利用相同温度下平衡常数不变进行计算.
解答:
解:(1)实验①前10min内A的平均反应速率为v=
=
=0.013mol/(L?min),故答案为:0.013;
(2)根据实验1、2数据分析,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol?L-1 ;温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂;
故答案为:1.0;催化剂;
(3)实验1、3比较,温度相同,10min-20min时,实验3的浓度减少量都大于实验1的,所以实验3的反应速率大于实验1的,即v3>v1;
实验1可知40min时反应达到平衡
2A(g)?B(g)+D(g)
起始(mol?L-1) 1.0 0 0
反应(mol?L-1) 0.50 0.25 0.25
平衡(mol?L-1) 0.50 0.25 0.25
该温度下平衡常数K=
=
;
实验3的温度与实验1的温度相同,温度不变,平衡常数不变;
2A(g)?B(g)+D(g)
起始(mol?L-1) C3 0 0
反应(mol?L-1) 0.6 0.30 0.30
平衡(mol?L-1) c3-0.60 0.30 0.30
该温度下平衡常数K=
=
;
解得:c3=1.2>1.0,
故答案为:>;>.
| △c |
| △t |
| 0.80mol/L-0.67mol/L |
| 10min |
(2)根据实验1、2数据分析,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol?L-1 ;温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂;
故答案为:1.0;催化剂;
(3)实验1、3比较,温度相同,10min-20min时,实验3的浓度减少量都大于实验1的,所以实验3的反应速率大于实验1的,即v3>v1;
实验1可知40min时反应达到平衡
2A(g)?B(g)+D(g)
起始(mol?L-1) 1.0 0 0
反应(mol?L-1) 0.50 0.25 0.25
平衡(mol?L-1) 0.50 0.25 0.25
该温度下平衡常数K=
| 0.25×0.25 |
| 0.502 |
| 1 |
| 4 |
实验3的温度与实验1的温度相同,温度不变,平衡常数不变;
2A(g)?B(g)+D(g)
起始(mol?L-1) C3 0 0
反应(mol?L-1) 0.6 0.30 0.30
平衡(mol?L-1) c3-0.60 0.30 0.30
该温度下平衡常数K=
| 0.30×0.30 |
| (c3-0.60)2 |
| 1 |
| 4 |
解得:c3=1.2>1.0,
故答案为:>;>.
点评:本题考查了化学平衡的分析判断,化学反应速率的计算应用,平衡常数概念和转化率概念的计算分析,注意影响平衡因素的分析判断条件,题目难度中等.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
下列变化会放出热量的是( )
| A、碘升华 |
| B、冰融化 |
| C、氢分子变成氢原子 |
| D、镁和盐酸反应 |
下列叙述正确的是( )
| A、1molH2SO4的质量为98g/mol |
| B、摩尔是7个基本物理量之一 |
| C、6.02×1022个H2SO4分子的质量为9.8g |
| D、CO2的摩尔质量是44g |
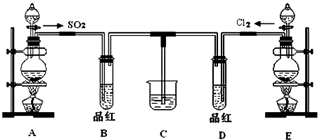
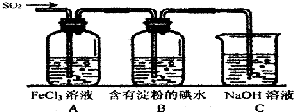 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示: