题目内容
4.在甲乙丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g)?2NH3(g)△H<0,相关数据如表所示:下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | lmol N2、3molH2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | C甲 | C乙 | C丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | v甲 | V乙 | V丙 |
| A. | V甲>V丙 | B. | C乙>C甲 | C. | K乙>K丙 | D. | V甲=V丙 |
分析 A、丙是恒温恒压条件下投2mol NH3,气体的物质的量增加,体积变大;
B、N2(g)+3H2(g)?2NH3(g)△H<0,逆反应是吸热反应,而乙是绝热恒容,平衡时的温度比甲的低,所以乙相当于在甲平衡的基础上降温;
C、正反应是放热反应,温度越高K值越小;
D、丙是恒温恒压条件下投2mol NH3,气体的物质的量增加,体积变大.
解答 解:A、丙是恒温恒压条件下投2mol NH3,反应逆向进行,气体的物质的量增加,体积变大,所以V甲<V丙,故A错误;
B、N2(g)+3H2(g)?2NH3(g)△H<0,逆反应是吸热反应,而乙是绝热恒容,平衡时的温度比甲的低,所以乙相当于在甲平衡的基础上降温,降低温度平衡正向移动,所以C乙>C甲,故B正确;
C、正反应是放热反应,温度越高K值越小,N2(g)+3H2(g)?2NH3(g)△H<0,逆反应是吸热反应,而乙是绝热恒容,平衡时的温度比丙的低,所以K乙>K丙,故C正确;
D、丙是恒温恒压条件下投2mol NH3,气体的物质的量增加,体积变大,所以V甲<V丙,故D错误;
故选BC.
点评 本题考查化学平衡及其影响,题目难度中等,明确反应条件对化学平衡的影响为解答关键,试题有利于提高学生的分析、理解能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.为探究NO3-的性质,某实验小组学生进行下列系列实验探究,请按要求回答下列问题.
【查阅资料】活泼金属与1mol/L稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原.
(l)实验I:生成NH4+电极反应式是NO3-+8e-+10 H+=NH4++3H2O;
(2)实验Ⅱ:电子流向:电子Mg电极经导线到Al极.
(3)实验Ⅲ:观察到的现象是电流计指针向右偏转,Mg电极上有无色气体产生,负极反应式为Al-3e-+4OH-=AlO2-+2H2O.
(4)实验IV:推测B中气体成分可能为NH3、H2.
【系列二】向盛有2mL 0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方气体无色,接近瓶口处显浅棕色.
(5)学生甲推测是NO3-氧化SO2,他的推测证据是溶液中有沉淀产生、接近瓶口处显浅棕色.
(6)学生乙则推测是溶液中溶解的O2也氧化了SO2,且设计了如下实验证明了自己的推测正确:向2mL0.1mol/LBaCl2溶液中缓慢通入SO2,若观察到现象:试管内有白色沉淀产生,则乙推测成立.
(7)分别用0.1mol/LBa(NO3)2、O2氧化等量的SO2,消耗二者物质的量之比为2:1.
| 【系列一】实验 | 溶液X | 实验现象 | |
| 实验Ⅰ | 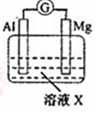 | 1mol/L稀硝酸 | 观察到电流计指针向左偏转. |
| 实验Ⅱ | 6mol/L稀硝酸 | 观察到电流计指针向左偏转,铝片表面产生无色气体,在液面上方变为红棕色 | |
| 实验Ⅲ | 6mol/LNaOH溶液 | 观察到(现象写在答题处). | |
| 实验Ⅳ | 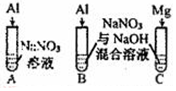 | A、C中均无明显现象,B中有无色气体生成. | |
(l)实验I:生成NH4+电极反应式是NO3-+8e-+10 H+=NH4++3H2O;
(2)实验Ⅱ:电子流向:电子Mg电极经导线到Al极.
(3)实验Ⅲ:观察到的现象是电流计指针向右偏转,Mg电极上有无色气体产生,负极反应式为Al-3e-+4OH-=AlO2-+2H2O.
(4)实验IV:推测B中气体成分可能为NH3、H2.
【系列二】向盛有2mL 0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方气体无色,接近瓶口处显浅棕色.
(5)学生甲推测是NO3-氧化SO2,他的推测证据是溶液中有沉淀产生、接近瓶口处显浅棕色.
(6)学生乙则推测是溶液中溶解的O2也氧化了SO2,且设计了如下实验证明了自己的推测正确:向2mL0.1mol/LBaCl2溶液中缓慢通入SO2,若观察到现象:试管内有白色沉淀产生,则乙推测成立.
(7)分别用0.1mol/LBa(NO3)2、O2氧化等量的SO2,消耗二者物质的量之比为2:1.
15.下列说法正确的是( )
| A. | 铁制水闸门常与直流电源的正极相连,可防止其腐蚀 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| D. | 一定温度下,CH3COOH稀溶液中加入少量的冰醋酸,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 |
12.化学与生活密切相关,下列说法不正确的是( )
| A. | 用燃烧法可鉴别羊毛制品和涤纶制品 | |
| B. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 | |
| C. | 二氧化硫可广泛用于食品的增白 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |
19.设NA为阿伏伽徳罗常数的值.下列有关叙述错误的是( )
| A. | 100g质量分数为46%的乙醇水溶液中氧原子数为4NA | |
| B. | 1molCl2通入水中,HClO、Cl-、ClO-粒子数之和小于2 NA | |
| C. | 标准状况下,2.24LD2中所含中子的数目是0.2NA | |
| D. | 25℃时,KSP(BaSO4)=l×10-10,则BaSO4饱和溶液中Ba2+数目为l×10-5NA |
9.下列褪色与二氧化硫漂白性有关的是( )
| A. | 溴水 | B. | 品红溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 滴入酚酞的氢氧化钠溶液 |
16.下列反应可在稀硫酸催化下进行的是( )
| A. | 卤代烃取代反应 | B. | 乙酸乙酯水解反应 | ||
| C. | 乙醇的催化氯化 | D. | 苯的溴代反应 |
5.室温时,pH=13的强碱溶液和pH=2的强酸溶液混合后,得到混合溶液的pH=12,则强碱与强酸的体积比为( )
| A. | 10:1 | B. | 1:10 | C. | 9:2 | D. | 2:9 |
6.在给定的条件下,下列选项所示的物质间均能通过一步转化实现的是( )
| A. | Fe$→_{高温}^{H_{2}O(g)}$Fe2O3$→_{高温}^{Al}$Al2O3 | |
| B. | Cu$→_{点燃}^{Cl_{2}}$CuCl2$\stackrel{FeCl_{3}(aq)}{→}$FeCl2 | |
| C. | FeS2$→_{高温}^{O_{2}}$SO2$\stackrel{H_{2}O_{2}(aq)}{→}$H2SO4 | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |