题目内容
6.短周期元素R、X、Y、Z原子序数依次增大,其中R的气态氢化物的水溶液呈碱性,X是同周期中原子半径最大的元素,Y的单质是一种常见的半导体材料,Y与Z的原子序数相差3,下列判断正确的是( )| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y>Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | Z的氢化物水溶液和Y最高价氧化物对应的水化物能相互反应 |
分析 短周期元素中,R的气态氢化物的水溶液呈碱性,则R是N元素,X是同周期中原子半径最大的元素,则X是Na素,Y的单质是一种常见的半导体材料,则Y为Si,Y与Z的原子序数相差3,Z的原子序数又大于硅,则Z是Cl元素,结合元素周期律与元素化合物性质解答.
解答 解:短周期元素中,R的气态氢化物的水溶液呈碱性,则R是N元素,X是同周期中原子半径最大的元素,则X是Na素,Y的单质是一种常见的半导体材料,则Y为Si,Y与Z的原子序数相差3,Z的原子序数又大于硅,则Z是Cl元素.
解:A.Z(Cl)、R(N)、Y(Si)的最外层电子数分别为:7、5、4,所以最外层电子数:Z>R>Y,故A正确;
B.非金属性越强氢化物越稳定,非金属性Z(Cl)>Y(Si),所以气态氢化物的稳定性:Z>Y,故B错误;
C.氮的氧化物是共价化合物,故C错误;
D.Z的氢化物为氨气,Y最高价氧化物对应的水化物硅酸,硅酸钠不能与弱碱性氨水反应,故D错误.
故选A.
点评 本题考查原子结构与元素周期律,侧重于位置结构性质关系,难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用.

练习册系列答案
相关题目
16.下列物质有固定熔沸点的是( )
| A. | CuSO4溶液 | B. | 石蜡 | C. | 玻璃 | D. | 白磷 |
17.如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压胶管的胶头,下列与实验事实不相符的是( )
| 选项 | 气体 | 溶液 | 现象 | 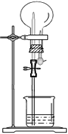 |
| A | NH3 | H2O含酚酞 | 红色喷泉 | |
| B | Cl2 | 饱和食盐水 | 无色喷泉 | |
| C | HCl | H2O含石蕊 | 红色喷泉 | |
| D | SO2 | NaOH溶液 | 无色喷泉 |
| A. | A | B. | B | C. | C | D. | D |
14.根据系统命名法,对烷烃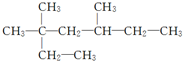 的命名正确的是( )
的命名正确的是( )
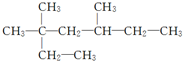 的命名正确的是( )
的命名正确的是( )| A. | 2,4-二甲基-2-乙基己烷 | B. | 3,5,5-三甲基庚烷 | ||
| C. | 3,3-二甲基-5-甲基庚烷 | D. | 3,3,5-三甲基庚烷 |
1.下列物质中,既能与盐酸又能与氢氧化钠溶液反应,且均有气体生成的化合物是( )
| A. | Si | B. | NH4HCO3 | C. | Al | D. | Al2O3 |
18.常温下0.1mol•L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A. | 提高溶液的温度 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2mol•L-1盐酸 | D. | 将溶液稀释到原体积的10倍 |
15.无机化学命名委员会(国际组织)在1999年作出决定,把长式周期表原先的主副族序号取消,由左到右按原顺序编为18列,按这个规定,下列说法正确的是( )
| A. | 第一列的元素都是金属元素 | |
| B. | 第三列所含的元素种类最多 | |
| C. | 第18列元素原子的最外层电子数均为8 | |
| D. | 只有第二列元素的最外层电子数为2 |
16.下列叙述错误的是( )
| A. | 通常情况下,甲烷和强酸、强碱、强氧化剂不起反应 | |
| B. | 光照下甲烷与氯气发生取代反应 | |
| C. | 甲烷的氯代物CHCl3、CCl4都难溶于水 | |
| D. | 甲烷在光照条件下与氧气反应 |
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. ;
;