题目内容
14. 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X极电极材料为铁,Y极电极材料为惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是2H++2e-=H2↑.
②该装置的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是纯铜,Y电极的材料是粗铜,
②Y电极的电极反应式Cu-2e-=Cu2+.(说明:杂质发生的电极反应不必写出)
(3)若X极材料为光滑的铁钉(已经处理),Y极的材料为锌,电解质溶液a为ZnCl2,①X极的电极反应式为Zn2++2e-=Zn
②Y极的电极反应式为Zn-2e-=Zn2+
③电解质溶液a的浓度将不变(填“增大”、“减少”、“不变”)
分析 (1)若X极电极材料为铁,Y极电极材料为惰性电极,a是饱和NaCl溶液,Y电极上氯离子放电生成氯气,X电极上氢离子放电,同时该电极附近生成氢氧根离子;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则X电极是纯铜、Y电极是粗铜,阴极上铜离子放电,阳极是铜失电子被氧化成铜离子进入溶液中;
(3)若X极材料为光滑的铁钉(已经处理),Y极的材料为锌,电解质溶液a为ZnCl2,阴极上锌离子放电,阳极是锌失电子被氧化成锌离子进入溶液中;
解答 解:(1)若X极电极材料为铁,Y极电极材料为惰性电极,a是饱和NaCl溶液,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,Y电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,电解化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:①2H++2e-=H2↑;②2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则与电源负极相连的阴极X是纯铜,阴极是铜离子放电,电极反应式为Cu2++2e-=Cu,与电源正极相连的阳极Y是粗铜,阳极发生反应为:Cu-2e-=Cu2+,
故答案为:①纯铜;粗铜;②Cu-2e-=Cu2+;
(3)若X极材料为光滑的铁钉(已经处理),Y极的材料为锌,电解质溶液a为ZnCl2,则与电源负极相连的阴极X是锌离子放电,电极反应式为Zn2++2e -=Zn,与电源正极相连的阳极Y是锌失电子,阳极发生反应为:Zn--2e -=Zn2+,整个电解质溶液不变,所以电解质溶液a的浓度将不变;
故答案为:①Zn2++2e -=Zn;Zn-2e -=Zn2+;②不变.
点评 本题考查原电池原理,为高频考点,侧重于学生的分析能力的考查,本题涉及电极反应式的书写等知识点,注意离子放电顺序及电极反应式的书写,题目难度不大.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | H2SO4 | B. | CuSO4 | C. | Fe2(SO4)3 | D. | AgNO3 |
| A. | 小苏打 | B. | 增白剂 | C. | 蔗糖 | D. | 食盐 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| D | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 组成苯的12个原子在同一平面上 | |
| B. | 苯环中6个碳碳键键长完全相同 | |
| C. | 苯的密度比水的小 | |
| D. | 苯只能发生取代反应,不能发生加成反应 |
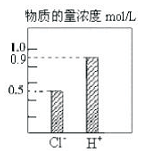 l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,
l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,