题目内容
将钠、镁、铝各0.1mol分别放入500mL 1mol?L-1的盐酸中,同温同压下产生的气体体积比是( )
| A、1:2:3 |
| B、6:3:2 |
| C、3:1:1 |
| D、1:1:1 |
考点:化学方程式的有关计算
专题:计算题
分析:根据反应物的量先判断金属与酸哪种过量,按不足量计算,注意钠与酸反应完会继续与水反应.
解答:
解:Na与盐酸、水反应都是生成氢气,由2Na~H2↑可知,0.1molNa完全反应生成氢气0.1mol×
=0.05mol,
500mL 1mol?L-1的盐酸中HCl的物质的量=0.5L×1mol/L=0.5mol,
由Mg+2HCl=MgCl2+H2↑可知,0.1molMg完全反应消耗HCl为0.1mol×2=0.2mol<0.5mol,故Mg完全反应,则生成氢气为0.1mol,
由2Al+6HCl=2AlCl3+3H2↑可知,0.1molAl完全反应消耗HCl为0.1mol×
=0.3mol<0.5mol,故Al完全反应,则生成氢气为0.1mol×
=0.15mol,
故同温同压下产生的气体体积比为0.05mol:0.1mol:0.15mol=1:2:3,
故选A.
| 1 |
| 2 |
500mL 1mol?L-1的盐酸中HCl的物质的量=0.5L×1mol/L=0.5mol,
由Mg+2HCl=MgCl2+H2↑可知,0.1molMg完全反应消耗HCl为0.1mol×2=0.2mol<0.5mol,故Mg完全反应,则生成氢气为0.1mol,
由2Al+6HCl=2AlCl3+3H2↑可知,0.1molAl完全反应消耗HCl为0.1mol×
| 6 |
| 2 |
| 3 |
| 2 |
故同温同压下产生的气体体积比为0.05mol:0.1mol:0.15mol=1:2:3,
故选A.
点评:本题考查化学方程式有关计算,难度不大,进行过量计算是关键,注意Na等一些活泼金属与酸反应完会继续与水反应.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温下,28g乙烯含有NA个C=C键 |
| B、1mol Cl2和足量NaOH溶液反应转移2NA个电子 |
| C、1L 0.1mol?L-1NaHCO3溶液含有0.1NA个CO32- |
| D、标况下,22.4升的乙醇含有NA个分子 |
实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O.关于该反应的下列说法,正确的是( )
| A、N2既是氧化剂,又是还原剂 |
| B、NH4Cl中的氮元素被还原 |
| C、被氧化的氮原子与被还原的氮原子之比为1:1 |
| D、每生成1mol N2时,转移电子的物质的量为6mol |
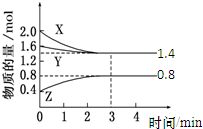 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.2 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3X(g)+Y(g)?2Z(g) |
| C、保持其他条件不变,增大压强,平衡向正反应方向移动 |
| D、温度不变,增大X的浓度,该反应的平衡常数不变 |
已知:①CH3OH(g)+H2O(g)═CO2(g)+3H2(g),△H=+49.0kJ?mol-1;②CH3OH(g)+
O2(g)=CO2(g)+2H2(g),△H=-192.9kJ?mol-1.下列说法正确的是( )
| 1 |
| 2 |
A、根据②推知反应:CH3OH(l)+
| ||
| B、①反应中,反应物的总能量高于生成物总能量 | ||
| C、CH3OH转变成H2的过程一定要吸收能量 | ||
D、反应②中的能量变化如图所示 |
如表为元素周期表前四周期的一部分,下列有关X、W、Y、R、Z五种元素的叙述中,正确的是( )
| X | |||
| W | Y | R | |
| Z | |||
| A、常温常压下,五种元素对应的单质中有两种是气态 |
| B、Y元素最高价氧化物对应水化物的酸性比W元素的弱 |
| C、Y、Z的阴离子电子层结构都与R原子的相同 |
| D、W的氢化物比X的氢化物稳定 |

 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题