题目内容
元素周期表反映了元素性质的周期性变化规律.请根据元素性质及题给信息回答下列问题:
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的最高正化合价 ;
②第三周期主族元素的最高价氧化物对应水化物的碱性 ;
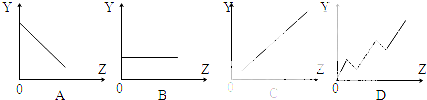
(2)某同学得到两张有关几种短周期元素信息的表格:
表一
表二
①上述两张表格中,指的是同种元素的是 .(填元素代号)
②在两张表格中,非金属性最强的元素原子的电子排布式为 ;金属性最强的元素位于周期表的第 周期 族.
③写出A、B、C形成的化合物的电子式 .
④在短周期主族元素中,E元素及与其相邻元素的原子半径从大到小的顺序是 (用元素符号表示).
⑤QT2形成的化合物在固态时为 晶体.
⑥请写出一个能说明D与L金属性强弱的事实 .
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的最高正化合价
②第三周期主族元素的最高价氧化物对应水化物的碱性
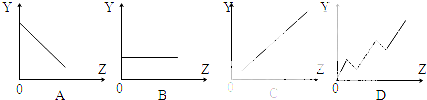
(2)某同学得到两张有关几种短周期元素信息的表格:
表一
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| 元素代号 | 元素特征信息 |
| A | 其单质是密度最小的物质. |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一. |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B元素可以形成两种以上的离子化合物. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
②在两张表格中,非金属性最强的元素原子的电子排布式为
③写出A、B、C形成的化合物的电子式
④在短周期主族元素中,E元素及与其相邻元素的原子半径从大到小的顺序是
⑤QT2形成的化合物在固态时为
⑥请写出一个能说明D与L金属性强弱的事实
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)①ⅡA族元素的原子最外层都是2个电子,所以最高正化合价都是+2价,据此判断;
②根据元素周期律,同周期元素,从左到右,非金属性逐渐增强,元素的最高价氧化物对应水化物的碱性逐渐减弱,据此判断;
(2)根据表一,L和R都为第ⅡA族元素,Q、T为ⅥA族元素,根据原子半径可知,L为镁元素,R为铍元素,Q为硫元素,T为氧元素,M为第ⅢA族元素,原子半径比L小,所以M为铝元素,根据表二,A为其单质是密度最小的物质,则A为氢元素,B为阴离子带两个单位负电荷,单质是空气的主要成分之一,则B为氧元素,C的阳离子与B的阴离子有相同的电子层结构,且与B元素可以形成两种以上的离子化合物,则C为钠元素,D的氢氧化物和氧化物都有两性,与C同周期,则D为铝元素,E与C同周期,原子半径在该周期最小,则E为氯元素,据此答题.
②根据元素周期律,同周期元素,从左到右,非金属性逐渐增强,元素的最高价氧化物对应水化物的碱性逐渐减弱,据此判断;
(2)根据表一,L和R都为第ⅡA族元素,Q、T为ⅥA族元素,根据原子半径可知,L为镁元素,R为铍元素,Q为硫元素,T为氧元素,M为第ⅢA族元素,原子半径比L小,所以M为铝元素,根据表二,A为其单质是密度最小的物质,则A为氢元素,B为阴离子带两个单位负电荷,单质是空气的主要成分之一,则B为氧元素,C的阳离子与B的阴离子有相同的电子层结构,且与B元素可以形成两种以上的离子化合物,则C为钠元素,D的氢氧化物和氧化物都有两性,与C同周期,则D为铝元素,E与C同周期,原子半径在该周期最小,则E为氯元素,据此答题.
解答:
解:(1)①ⅡA族元素的原子最外层都是2个电子,所以最高正化合价都是+2价,化合价都相同,故选B;
②根据元素周期律,同周期元素,从左到右,非金属性逐渐增强,元素的最高价氧化物对应水化物的碱性逐渐减弱,故选A;
(2)根据表一,L和R都为第ⅡA族元素,Q、T为ⅥA族元素,根据原子半径可知,L为镁元素,R为铍元素,Q为硫元素,T为氧元素,M为第ⅢA族元素,原子半径比L小,所以M为铝元素,根据表二,A为其单质是密度最小的物质,则A为氢元素,B为阴离子带两个单位负电荷,单质是空气的主要成分之一,则B为氧元素,C的阳离子与B的阴离子有相同的电子层结构,且与B元素可以形成两种以上的离子化合物,则C为钠元素,D的氢氧化物和氧化物都有两性,与C同周期,则D为铝元素,E与C同周期,原子半径在该周期最小,则E为氯元素,
①根据上面的分析可知,在上述两张表格中,指的是同种元素的是T和B都氧元素,M和D都是铝元素,故答案为:T和B,M和D;
②在两张表格中,非金属性最强的元素为氧元素,其原子的电子排布式为1s22s22p4;金属性最强的元素为钠元素,位于周期表的第三周期ⅠA族,
故答案为:1s22s22p4;三;ⅠA;
③写出A、B、C形成的化合物为氢氧化钠,它的电子式为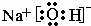 ,故答案为:
,故答案为: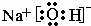 ;
;
④E为氯元素及与其相邻元素有氟元素和硫元素,它们的原子半径从大到小的顺序是S>Cl>F,故答案为:S>Cl>F;
⑤QT2形成的化合物是SO2,在固态时为分子晶体,故答案为:分子;
⑥根据元素周期律,金属性越强,对应的最高价氧化物的水化物碱性就越强,氢氧化镁的碱性比氢氧化铝强,就说明镁的金属性比铝强,故答案为:氢氧化镁的碱性比氢氧化铝强.
②根据元素周期律,同周期元素,从左到右,非金属性逐渐增强,元素的最高价氧化物对应水化物的碱性逐渐减弱,故选A;
(2)根据表一,L和R都为第ⅡA族元素,Q、T为ⅥA族元素,根据原子半径可知,L为镁元素,R为铍元素,Q为硫元素,T为氧元素,M为第ⅢA族元素,原子半径比L小,所以M为铝元素,根据表二,A为其单质是密度最小的物质,则A为氢元素,B为阴离子带两个单位负电荷,单质是空气的主要成分之一,则B为氧元素,C的阳离子与B的阴离子有相同的电子层结构,且与B元素可以形成两种以上的离子化合物,则C为钠元素,D的氢氧化物和氧化物都有两性,与C同周期,则D为铝元素,E与C同周期,原子半径在该周期最小,则E为氯元素,
①根据上面的分析可知,在上述两张表格中,指的是同种元素的是T和B都氧元素,M和D都是铝元素,故答案为:T和B,M和D;
②在两张表格中,非金属性最强的元素为氧元素,其原子的电子排布式为1s22s22p4;金属性最强的元素为钠元素,位于周期表的第三周期ⅠA族,
故答案为:1s22s22p4;三;ⅠA;
③写出A、B、C形成的化合物为氢氧化钠,它的电子式为
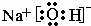 ,故答案为:
,故答案为: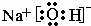 ;
;④E为氯元素及与其相邻元素有氟元素和硫元素,它们的原子半径从大到小的顺序是S>Cl>F,故答案为:S>Cl>F;
⑤QT2形成的化合物是SO2,在固态时为分子晶体,故答案为:分子;
⑥根据元素周期律,金属性越强,对应的最高价氧化物的水化物碱性就越强,氢氧化镁的碱性比氢氧化铝强,就说明镁的金属性比铝强,故答案为:氢氧化镁的碱性比氢氧化铝强.
点评:本题主要考查了电子式、元素周期律、晶体的类别等知识点,中等难度,解题关键在于要熟悉元素周期表和原子结构的特点,进而确定元素种类.

练习册系列答案
相关题目
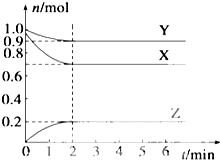 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A、该反应的化学方程式为3X+Y═2Z |
| B、2 min时,反应达最大限度,但化学反应仍在进行 |
| C、反应开始至2 min,Z的反应速率为0.10 mol?L-1?min-1 |
| D、反应达到平衡时,压强是开始时的0.9倍 |
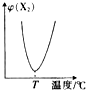 两种气体单质按以下化学方程式反应:X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是( )
两种气体单质按以下化学方程式反应:X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是( )| A、放热反应 |
| B、吸热反应 |
| C、可能是放热反应,也可能是吸热反应 |
| D、无法判断反应类型 |
最简式相同,但既不是同系物又不是同分异构体的是( )
A、CH≡CH和 |
| B、甲醚和甲醇 |
| C、环丙烷和环己烷 |
D、 |
为解决全球能源与环境问题,节能减排已成共识.下列措施不利于节能减排的有( )
| A、举行“地球一小时”熄灯活动 |
| B、露天焚烧稻草和秸秆 |
| C、夏天将空调的温度设置在26℃以上 |
| D、生活垃圾分类回收处理 |
相同体积的Na2SO4溶液(浓度为c1)和Al2(SO4)3溶液(浓度为c2),若其中SO42-的物质的量浓度相同,则c1和c2的关系是( )
| A、c1=c2 |
| B、c1=3 c2 |
| C、c2=3 c1 |
| D、无法确定 |
下列说法中正确的是( )
| A、固体NaCl不导电,但NaCl是电解质 |
| B、Cu能导电,所以Cu是电解质 |
| C、NH3溶于水能导电,所以NH3是电解质 |
| D、BaSO4的水溶液不导电,所以BaSO4是非电解质 |