题目内容
15.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2.图是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是减小(填“增大”、“减小”、“不变”),反应热△H的变 化是不变(填“增大”、“减小”、“不变”).请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol.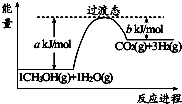
分析 化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变.根据图象可知反应热=akJ/mol-bkJ/mol,所以CH3OH(g)和H2O(g)反应的热化学方程式为CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol.
解答 解:催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变,反应能量图中生成物的总能量大于反应物的总能量,则为吸热反应,由图可知,1mol 甲醇和1mol 水蒸气反应生成CO2和氢气吸收的热量为(a-b)kJ,反应热化学方程式为:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol,
故答案为:减小;不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol.
点评 本题主要是考查催化剂对反应速率、反应热的影响、盖斯定律应用,注意原电池和电解池的原理分析,题目难度中等.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
16.向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,经洗涤、干燥、灼烧,得到黑色固体质量为32g.下列有关说法不正确的是( )
| A. | 原混合物中含氧原子的质量为1.6g | |
| B. | 原硝酸的物质的量浓度为2.0mol/L | |
| C. | 反应中产生标况下NO的体积为4.48L | |
| D. | 固体物质溶解后剩余HNO3为0.2mol |
6.下列关于沉淀溶解平衡的说法正确的是( )
| A. | Ksp(AB2)小于Ksp(CD),则化合物AB2的溶解度一定小于化合物CD的溶解度 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的溶解度增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
10.化工生产中常用 FeS 作沉淀剂除去工业废水中的 Cu2+:Cu2+(aq)+FeS(s)?CuS(s)+Fe2+(aq),下列有关叙述中正确的是( )
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 溶液中加入少量 Na2S固体后,溶液中c (Cu2+)、c (Fe2+)都减小 | |
| D. | 该反应平衡常数 K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
4.氯碱厂质检人员用滴定法测定某NaOH溶液的浓度.
(1)洗涤滴定管前必须首先检漏.
(2)选用盐酸作为标准溶液进行测定实验.将盐酸装入滴定管,NaOH溶液装入锥形瓶,滴加甲基橙/酚酞作指示剂.滴定时,眼睛注视锥形瓶中溶液颜色的变化,当锥形瓶内溶液由黄色变橙色/红色变无色、且在半分钟内不褪去即达滴定终点.记录此时滴定管内液面读数V(末).
(3)实验数据记录及处理:
标准盐酸浓度:0.1054mol/L
若NaOH溶液的准确浓度为 0.1005mol/L,实验误差是5.4%.
(4)若测定结果偏低,原因可能是ACD.
A、见到指示剂的颜色有变化就停止滴定
B、锥形瓶用蒸馏水清洗后,未用待装液润洗
C、读数时,若滴定前视线偏低,滴定后视线偏高
D、滴定前滴定管的尖嘴部分充满液体,滴定终点时尖嘴部分有气泡.
(1)洗涤滴定管前必须首先检漏.
(2)选用盐酸作为标准溶液进行测定实验.将盐酸装入滴定管,NaOH溶液装入锥形瓶,滴加甲基橙/酚酞作指示剂.滴定时,眼睛注视锥形瓶中溶液颜色的变化,当锥形瓶内溶液由黄色变橙色/红色变无色、且在半分钟内不褪去即达滴定终点.记录此时滴定管内液面读数V(末).
(3)实验数据记录及处理:
标准盐酸浓度:0.1054mol/L
| 实验次数 | 待测氢氧化钠溶液体积(mL) | 标准盐酸体积(mL) | NaOH溶液浓度(mol/L) | ||
| 初读数 | 末读数 | 体积 | |||
| 1 | 20.00 | 0.50 | 20.70 | 20.20 | 0.1059 |
| 2 | 20.00 | 6.00 | 26.00 | 20.00 | |
(4)若测定结果偏低,原因可能是ACD.
A、见到指示剂的颜色有变化就停止滴定
B、锥形瓶用蒸馏水清洗后,未用待装液润洗
C、读数时,若滴定前视线偏低,滴定后视线偏高
D、滴定前滴定管的尖嘴部分充满液体,滴定终点时尖嘴部分有气泡.
5.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
| A. | 45g水中含有的水分子数是2.5NA | |
| B. | 标准状况下,33.6LCO中含有的原子数是3NA | |
| C. | 0.5L、0.2mol/L的NaCl溶液中含有的Na+数是0.1NA | |
| D. | 1molCH4含电子数目为8NA |
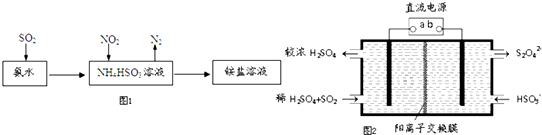 SO2和NOx都是大气污染物.
SO2和NOx都是大气污染物.