题目内容
4.氯碱厂质检人员用滴定法测定某NaOH溶液的浓度.(1)洗涤滴定管前必须首先检漏.
(2)选用盐酸作为标准溶液进行测定实验.将盐酸装入滴定管,NaOH溶液装入锥形瓶,滴加甲基橙/酚酞作指示剂.滴定时,眼睛注视锥形瓶中溶液颜色的变化,当锥形瓶内溶液由黄色变橙色/红色变无色、且在半分钟内不褪去即达滴定终点.记录此时滴定管内液面读数V(末).
(3)实验数据记录及处理:
标准盐酸浓度:0.1054mol/L
| 实验次数 | 待测氢氧化钠溶液体积(mL) | 标准盐酸体积(mL) | NaOH溶液浓度(mol/L) | ||
| 初读数 | 末读数 | 体积 | |||
| 1 | 20.00 | 0.50 | 20.70 | 20.20 | 0.1059 |
| 2 | 20.00 | 6.00 | 26.00 | 20.00 | |
(4)若测定结果偏低,原因可能是ACD.
A、见到指示剂的颜色有变化就停止滴定
B、锥形瓶用蒸馏水清洗后,未用待装液润洗
C、读数时,若滴定前视线偏低,滴定后视线偏高
D、滴定前滴定管的尖嘴部分充满液体,滴定终点时尖嘴部分有气泡.
分析 (1)滴定管使用前要检漏;
(2)一般标准液装滴定管内,待测液装锥形瓶,指示剂可选酚酞甲基橙,视线注视锥形瓶内溶液颜色的变化判定滴定终点.
(3)先求出盐酸溶液的平均体积,然后根据HCl~NaOH求NaOH溶液的物质的量浓度;再根据NaOH溶液的准确浓度为 0.1005mol/L计算误差;
(4)根据c(待测)=$\frac{c(标准)V(标准)}{c(待测)}$分析误差.
解答 解(1)滴定管使用前需要检漏,所以洗涤前必须首先检漏;
故答案为:检漏;
(2)一般标准液装滴定管内,待测液装锥形瓶,所以盐酸放滴定管中,氢氧化钠放锥形瓶内;指示剂可选酚酞,红色变无色滴定完成,或者选甲基橙,黄色变橙色滴定完成;视线注视锥形瓶内溶液颜色的变化判定滴定终点,终点颜色突变后半分钟内不恢复即为终点.
故答案为:滴定管;锥形瓶;甲基橙/酚酞;锥形瓶中溶液颜色的变化;溶液由黄色变橙色/红色变无色、且在半分钟内不褪去;
(3)两次消耗的盐酸标准液的体积为20.20mL,20.00mL,消耗盐酸溶液的平均体积为$\frac{20.20mL+20.00mL}{2}$=20.10mL,
HCl~NaOH
1 1
0.1054mol/L×20.10mL×10-3 c(HCl)×20.00mL×10-3
解得:c(HCl)=$\frac{0.1054mol/L×20.10mL×1{0}^{-3}}{20.00×1{0}^{-3}}$=0.1059mol/L,NaOH溶液的准确浓度为 0.1005mol/L,则误差为:$\frac{0.1059-0.1005}{0.1005}$×100%=5.4%;
故答案为:20.20;20.00;0.1059;5.4;
(4)A、见到指示剂的颜色有变化就停止滴定,反应不充分,标准液体积偏小,测定结果偏低,故A正确;
B、锥形瓶用蒸馏水清洗后,未用待装液润洗,不影响测定结果,故B错误;
C、读数时,若滴定前视线偏低,滴定后视线偏高,标准液体积读数偏小,测定结果偏低,故C正确;
D、滴定前滴定管的尖嘴部分充满液体,滴定终点时尖嘴部分有气泡,气泡占一部分体积,故标准液体积读数偏小,测定结果偏低,故D正确.
故答案为:ACD.
点评 本题主要考查了中和滴定操作、化学计算以及注意事项,难度不大,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 乙烯的结构简式:CH2CH2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 甲烷的结构式:CH4 | D. | 甲苯的键线式: |
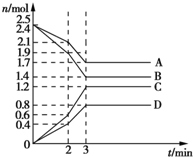 在某容积为2L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化如图所示.下列说法正确的是( )
在某容积为2L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化如图所示.下列说法正确的是( )| A. | 前2min内,v(A)=0.2 mol/(L•min) | |
| B. | 在2min时,图象发生改变的原因只可能是增大压强 | |
| C. | 其他条件不变,3min时体系的压强不再发生变化 | |
| D. | 增加气体D的浓度,A的反应速率随之减小 |
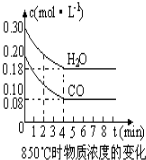 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0,CO和H2O浓度变化如图.
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0,CO和H2O浓度变化如图.t℃时物质浓度(mol•L-1)的变化:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
(2)850℃时,此反应的平衡常数K=1,若保持温度、体积不变,起始时CO和H2O的浓度均为0.2mol•L-1,则达平衡时CO的转化率为50%.在850℃时,若上述反应体系中各物质浓度为C(CO)=0.07mol•L-1C(H2O)=0.17mol•L-1C( CO2)=0.13mol•L-1C(H2)=0.13mol•L-1,则此时该反应向逆方向移动.
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3min~4min之间反应处于平衡状态; c 1数值大于0.08mol•L-1 (填大于、小于或等于)
②反应在4min~5min间,平衡向逆方向移动,可能的原因是d (单选),表中5min~6min之间数值发生变化,可能的原因是a (单选)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
| A. | Na2CO3 | B. | NaOH | C. | Mg(OH)2 | D. | NH3•H2O |
| A. | CaCO3+2H+=Ca2++CO2↑+H2O | B. | 2Fe2++Cl2=2Fe3++2Cl- | ||
| C. | HCO3-+H+=CO2↑+H2O | D. | H++OH-=H2O |
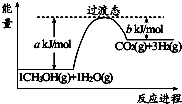
 2NH3(g)△H=-92kJ•mol-1.
2NH3(g)△H=-92kJ•mol-1.