题目内容
有13.5g不纯的CuCl2粉末(内含一种杂质),当它与足量的AgNO3溶液反应时,产生了29gAgCl沉淀,则该粉末中的杂质可能是( )
| A、FeCl3 |
| B、CaCl2 |
| C、ZnCl2 |
| D、BaCl2 |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:(1)用假设法求解,13.5gCuCl2 与足量盐酸反应生成28.7gAgCl.因为28.7g<29g,说明CuCl2样品中混有的杂质能与硝酸银反应,并且与同质量的CuCl2相比产生AgCl的质量多,即杂质中所含氯元素的质量分数高于CuCl2中氯元素的质量分数;
(2)分别计算出CuCl2、BaCl2、CaCl2、AlCl3、ZnCl2中氯元素的质量分数,然后比较得出答案.
(2)分别计算出CuCl2、BaCl2、CaCl2、AlCl3、ZnCl2中氯元素的质量分数,然后比较得出答案.
解答:
解:假设13.5g为纯的CuCl2,则生成AgCl的质量为:
CuCl2+2AgNO3=Cu(NO3)2+2AgCl↓
135 2×143.5
13.5g x
=
,解得:x=28.7g<29g,
现为29g,则样品中氯元素的质量分数应大于CuCl2中氯元素的质量分数,CuCl2、FeCl3、CaCl2、AlCl3、ZnCl2中氯元素的质量分数分别为:
CuCl2
×100%≈52.6%;
FeCl3
×100%≈65.5%;
CaCl2
×100%≈64.0%;
ZnCl2
×100%≈52.2%;
BaCl2
×100%≈34.1%;
FeCl3、CaCl2中氯元素的质量分数大于CuCl2中氯元素的质量分数.
故选:AB.
CuCl2+2AgNO3=Cu(NO3)2+2AgCl↓
135 2×143.5
13.5g x
| 135 |
| 13.5g |
| 287 |
| x |
现为29g,则样品中氯元素的质量分数应大于CuCl2中氯元素的质量分数,CuCl2、FeCl3、CaCl2、AlCl3、ZnCl2中氯元素的质量分数分别为:
CuCl2
| 2×35.5 |
| 64+2×35.5 |
FeCl3
| 3×35.5 |
| 3×35.5+56 |
CaCl2
| 71 |
| 71+40 |
ZnCl2
| 71 |
| 71+65 |
BaCl2
| 2×35.5 |
| 2×35.5+137 |
FeCl3、CaCl2中氯元素的质量分数大于CuCl2中氯元素的质量分数.
故选:AB.
点评:本题考查混合物的计算,本题可用平均值法和变形法相结合来速解,在解此类题时,可以应用假设法假设所给质量是纯净物的质量,计算出生成沉淀的质量,再找出物质之间的质量关系,用平均值法进行分析解答,要细心分析,题目难度中等.

练习册系列答案
相关题目
用3g铁屑与适量1mol/L稀硫酸反应制取H2气体,若要增大反应速率,可采取的措施是( )
①再加入适量1mol/L硫酸 ②改用3mol/L硫酸 ③改用3g铁粉 ④适当升高温度⑤加几滴CuSO4溶液 ⑥用98%浓硫酸代替1mol/L稀硫酸.
①再加入适量1mol/L硫酸 ②改用3mol/L硫酸 ③改用3g铁粉 ④适当升高温度⑤加几滴CuSO4溶液 ⑥用98%浓硫酸代替1mol/L稀硫酸.
| A、①②④⑤ | B、②③④⑤ |
| C、①③④⑤ | D、②③④⑤⑥ |
下列离子方程式书写正确的是( )
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2CH2OH
| ||
| B、过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | ||
| C、向CuSO4溶液中滴加过量的氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ | ||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O═NaHCO3↓+NH4+ |
能正确表示下列反应的离子方程式是( )
| A、碳酸钠溶液和醋酸反应:2H++CO32-═CO2↑+H2O |
| B、Na2S水解:S2-+2H2O═H2S+2OH- |
| C、镁粉撒入NH4Cl溶液:Mg+2H+═Mg2++H2↑ |
| D、Mg(HCO3)2溶液和足量NaOH溶液反应:Mg2++4OH-+2HCO3-═Mg(OH)2↓+2CO32-+2H2O |
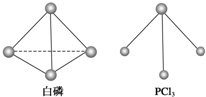 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10. 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示: 磷酸的结构式可用如图表示.磷酸在一定条件下能发生①号键与②′号键的同时断裂:
磷酸的结构式可用如图表示.磷酸在一定条件下能发生①号键与②′号键的同时断裂: