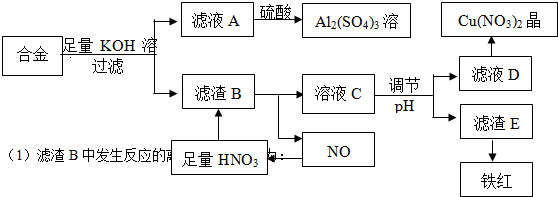
题目内容
2.已知:A是石油裂解气的主要成分,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.请回答下列问题: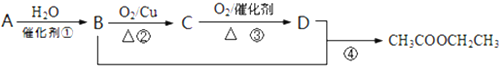
(1)B物质中官能团的名称羟基;
(2)写出反应②的化学方程式(及反应类型):2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应.
(3)写出C与银氨溶液反应的化学方程式:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$2Ag↓+CH3COONH4+3NH3+H2O.
(4)写出乙酸乙酯在碱性条件下水解的化学方程式(及反应类型):CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+HOCH2CH3,取代反应.
分析 A是石油裂解气的主要成分,现以A为主要原料合成乙酸乙酯,由转化关系可知,B为CH3CH2OH,D为CH3COOH,B氧化得到C为CH3CHO,C氧化可以CH3COOH,A与水发生加成反应得到CH3CH2OH,则A为CH2=CH2,据此解答.
解答 解:A是石油裂解气的主要成分,现以A为主要原料合成乙酸乙酯,由转化关系可知,B为CH3CH2OH,D为CH3COOH,B氧化得到C为CH3CHO,C氧化可以CH3COOH,A与水发生加成反应得到CH3CH2OH,则A为CH2=CH2,
(1)B为CH3CH2OH,含有官能团为:羟基,
故答案为:羟基;
(2)乙醇催化氧化生产乙醛,反应的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,属于氧化反应
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应;
(3)乙醛与银氨溶液发生银镜反应,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$2Ag↓+CH3COONH4+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$2Ag↓+CH3COONH4+3NH3+H2O;
(4)乙酸乙酯在碱性条件下水解的化学方程式:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+HOCH2CH3,属于取代反应,
故答案为:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+HOCH2CH3;取代反应.
点评 本题考查无机物推断,涉及烯烃、醇、醛、羧酸的性质与转化,比较基础,侧重对基础知识的巩固.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目
12.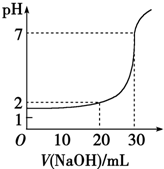 如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )
如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )
 如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )
如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )| A | B | C | D | |
| c(HCl)/mol•L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
| c(NaOH)/mol•L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
| A. | A | B. | B | C. | C | D. | D |
13.下列说法中正确的是( )
| A. | 放热反应不一定不需要加热,但吸热反应一定需要加热 | |
| B. | 中和反应都是放热反应 | |
| C. | 氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量低 | |
| D. | C与CO2反应是吸热反应 |
10.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)
7.下列气体溶于水后,不发生氧化还原反应的是( )
| A. | SO2 | B. | NO2 | C. | CO2 | D. | NH3 |
11.已知乙烯分子中碳原子以3个sp2杂化轨道与碳原子或氢原子形成σ键,两个碳原子上未参与杂化的p轨道形成π键.下列关于乙烯分子的叙述中正确的是( )
| A. | 乙烯分子2个碳原子和4个氢原子不可能在同一个平面内 | |
| B. | 乙烯分子中键角约为109°28′,所有原子在同一个平面内 | |
| C. | 乙烯分子中碳碳双键的键能比乙烷分子中碳碳单键的键能小 | |
| D. | 乙烯比乙烷活泼,说明碳碳之间的π键比σ键键能小,易发生反应 |
12.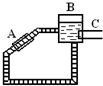 太阳能的开发和利用是21世纪的一个重要课题.
太阳能的开发和利用是21世纪的一个重要课题.
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
其中最适宜作储能介质的是B(填字母).
A、CaCl2•6H2O B、Na2SO4•10H2O C、Na2HPO4•12H2O D、Na2S2O3•5H2O
②如图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.根据
对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.
 太阳能的开发和利用是21世纪的一个重要课题.
太阳能的开发和利用是21世纪的一个重要课题.①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
A、CaCl2•6H2O B、Na2SO4•10H2O C、Na2HPO4•12H2O D、Na2S2O3•5H2O
②如图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.根据
对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.