题目内容
13.美国通用原子能公司(GA)提出的碘硫热化学循环是由反应Ⅰ、Ⅱ、Ⅲ三步反应组成的(如图所示),下列有关说法正确的是( )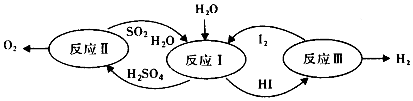
| A. | 设计该循环是为了制取能源气体O2 | |
| B. | 整个循环过程中产生1mol O2的同时产生1molH2 | |
| C. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 | |
| D. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 |
分析 由图可知,反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI,该反应为SO2+2H2O+I2=H2SO4+2HI,反应Ⅲ是2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+I2↑,反应Ⅱ是硫酸分解为氧气的过程,据此回答.
解答 解:A.设计该循环是为了制取气体O2和H2,故A错误;
B.整个循环过程中产生1molO2的同时产生标况下44.8LH2,故B错误;
C.反应Ⅱ、Ⅲ不可在常温常压下进行,反应SO2+2H2O+I2=H2SO4+2HI可以在常温下进行,故C错误;
D.反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI,该反应为SO2+2H2O+I2=H2SO4+2HI,反应Ⅲ是2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+I2↑,反应Ⅱ是硫酸分解为氧气的过程,均为氧化还原反应,故D正确.
故选D.
点评 本题涉及物质的转化和氧化还原反应的有关知识,注意知识的归纳和梳理是解题的关键,难度中等,注意从化合价的角度分析氧化还原反应.

练习册系列答案
相关题目
3.有关于化学实验的操作或者说法中,正确的是( )
| A. | 用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低 | |
| B. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| C. | 将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 | |
| D. | 将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
1.下列说法不正确的是( )
| A. | 氢氧化铁胶体可用于净水 | |
| B. | 镁合金可用于制造导弹、飞机的部件 | |
| C. | 石灰石-石膏法可用于燃煤的脱硫 | |
| D. | 焦炭在炼铁高炉中用于直接还原铁矿石 |
5.下列说法正确的是( )
| A. | N2、O2和Cl2分子中既含有σ键,又含有π键 | |
| B. | PCl3分子中,中心原子采取SP3杂化方式 | |
| C. | CS2、H2O、C2H2都是直线型分子 | |
| D. | CH4、CCl4、C6H6都是只含有极性键的非极性分子 |

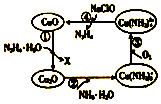 水合肼(N2H4•H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性.将水合肼通入CuO胶体中,可发生如图所示的转化.
水合肼(N2H4•H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性.将水合肼通入CuO胶体中,可发生如图所示的转化.