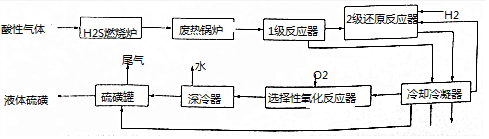
题目内容
5.下列说法正确的是( )| A. | N2、O2和Cl2分子中既含有σ键,又含有π键 | |
| B. | PCl3分子中,中心原子采取SP3杂化方式 | |
| C. | CS2、H2O、C2H2都是直线型分子 | |
| D. | CH4、CCl4、C6H6都是只含有极性键的非极性分子 |
分析 A.单键均为σ键,双键、三键中均含σ键、π键;
B.根据中心原子的价层电子对数判断,价层电子对个数=σ键个数+孤电子对个数;
C.H2O是V形分子;
D.不同非金属原子间形成极性键,相同非金属原子间形成非极性键.
解答 解:A.N2中含有三键,O2中含有双键,所以N2、O2分子中既含有σ键,又含有π键,Cl2分子只有单键,即只含有σ键,故A错误;
B.PCl3分子中P的价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,则中心原子采取SP3杂化方式,故B正确;
C.H2O是V形分子,CS2、C2H2都是直线型分子,故C错误;
D.CH4、CCl4只含有极性键,结构对称属于非极性分子,C6H6中含有非极性键和极性键,是非极性分子,故D错误.
故选B.
点评 本题考查了共价键、分子的极性、原子杂化方式的判断,根据价层电子对互斥理论来分析解答即可,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
16.下列各组物质的熔点均与所含化学键的键能有关的是( )
| A. | CaO 与CO2 | B. | NaCl与HCI | C. | SiC 与SiO2 | D. | CCl4与I2 |
13.美国通用原子能公司(GA)提出的碘硫热化学循环是由反应Ⅰ、Ⅱ、Ⅲ三步反应组成的(如图所示),下列有关说法正确的是( )
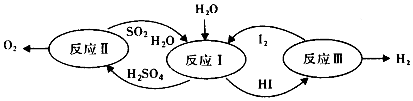

| A. | 设计该循环是为了制取能源气体O2 | |
| B. | 整个循环过程中产生1mol O2的同时产生1molH2 | |
| C. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 | |
| D. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 |
20.关于下列各实验装置的叙述中,不正确的是( )
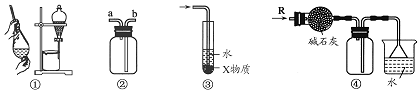

| A. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| B. | 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| C. | 装置①可用于分离C2H5OH和H2O的混合物 | |
| D. | 装置④可用于干燥、收集NH3,并吸收多余的NH3 |
10.下列物质在水溶液中的电离方程式书写正确的是( )
| A. | KClO3═K++3O2-+Cl5+ | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO4═H++SO42- | D. | Al2(SO4)3═2Al3++3SO42- |
19.将O2和NH3的混合气体448mL通过加热的三氧化二铬(催化剂),充分反应后,再通过足量的水,最终收集到44.8mL氧气.原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
已知:NO在 O2存在时与水可按4NO+3O2+2H2O=4HNO3反应进行.
已知:NO在 O2存在时与水可按4NO+3O2+2H2O=4HNO3反应进行.
| A. | 231.5mL | B. | 268.8mL | C. | 287.5mL | D. | 313.6mL |
20.下列有关金属元素说法正确的是( )
| A. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作水的消毒剂 | |
| C. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| D. | 氯化铝是一种电解质,可用于电解法制铝 |
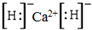 ;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.
;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.