题目内容
5.在密闭容器内,下列已达到平衡的化学反应中,当升高温度并同时减小压强时,平衡一定向右移动的是( )| A. | A(g)+2B(g)?2C(g);△H1>0 | B. | A(g)+B(g)?C(g)+D(g);△H2>0 | ||
| C. | A(s)+2B(g)?C(g);△H3>0 | D. | A(s)?B(g)+C(g);△H4<0 |
分析 当升高温度并同时减小压强时,平衡一定向右移动,则该反应升高温度和减小压强都要向右移动,所以该反应为正反应是气体体积增大的吸热反应,据此分析.
解答 解:当升高温度并同时减小压强时,平衡一定向右移动,则该反应升高温度和减小压强都要向右移动,所以该反应为正反应是气体体积增大的吸热反应,或是压强变化对平衡无影响,升高温度,平衡正向移动的吸热反应,所以只有B符合条件,故选:B.
点评 本题考查了化学平衡的影响因素,题目难度不大,注意物质的状态.

练习册系列答案
相关题目
12.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( )
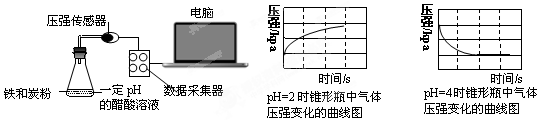

| A. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| B. | 生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍 | |
| C. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |
16.羰基硫(O=C=S)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染.羰基硫的氢解反应和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)?H2S(g)+CO(g)△H1=+7KJ•mol-1
②水解反应:COS(g)+H2O(g)?H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如下:
回答下列问题: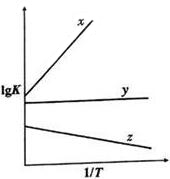
(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为3.5KJ.
(2)已知热化学方程式CO(g)+H2O(g)?H2(g)+CO2(g)△H3 则△H3=-42KJ•mol-1.
(3)氢解反应平衡后增大容器的体积,则正反应速率减小,COS的转化率不变(填“增大”或“减小”或“不变”).
(4)COS氢解反应的平衡常数K与温度T具有如下的关系式lgK=$\frac{a}{T}$+b,式中a和b均为常数.
①如图中,表示COS氢解反应的直线为z,判断依据为氢解反应为吸热反应,升高温度,k增大.
②一定条件下,催化剂A和B对COS的氢解均具有催化作用,相关数据如下表所示:
则a1=a2(填“>”或“<”或“=”),判断a1和a2大小的依据为K的数值只与温度有关,与催化剂无关.
③某温度下,在体积不变的容器中,若COS和H2的起始体积比为1:V,平衡后COS和H2的体积比为1:10V,则此温度下该反应的化学平衡常数K=$\frac{81V}{10(V-1)^{2}}$.
①氢解反应:COS(g)+H2(g)?H2S(g)+CO(g)△H1=+7KJ•mol-1
②水解反应:COS(g)+H2O(g)?H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如下:
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| E/(KJ•mol-1) | 803 | 742 | 577 | 339 | 465 |

(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为3.5KJ.
(2)已知热化学方程式CO(g)+H2O(g)?H2(g)+CO2(g)△H3 则△H3=-42KJ•mol-1.
(3)氢解反应平衡后增大容器的体积,则正反应速率减小,COS的转化率不变(填“增大”或“减小”或“不变”).
(4)COS氢解反应的平衡常数K与温度T具有如下的关系式lgK=$\frac{a}{T}$+b,式中a和b均为常数.
①如图中,表示COS氢解反应的直线为z,判断依据为氢解反应为吸热反应,升高温度,k增大.
②一定条件下,催化剂A和B对COS的氢解均具有催化作用,相关数据如下表所示:
| 达到平衡所需的时间/min | a的数值 | b的数值 | |
| 催化剂A | t | a1 | b1 |
| 催化剂B | 2t | a2 | b2 |
③某温度下,在体积不变的容器中,若COS和H2的起始体积比为1:V,平衡后COS和H2的体积比为1:10V,则此温度下该反应的化学平衡常数K=$\frac{81V}{10(V-1)^{2}}$.
13.从能量的变化和反应的快慢等角度研究反应是有重要意义:
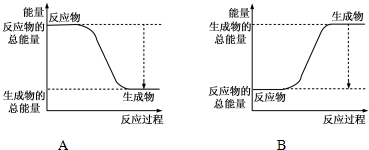
(1)已知反应2H2+O2=H2O为放热反应,下图能正确表示该反应中能量变化的是A.
从断键和成键的角度分析上述反应中能量的变化.
化学键的键能如表:则生成1mol水可以放出热量242kJ
(2)原电池可将化学能转化为电能.将质量相
同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是Zn,正极的反应式为Cu2++2e-=Cu,电解质溶液中SO42- 移向负极(填“正”或“负”).一段时间后,取出洗净、干燥、称量,二者质量差为12.9g.则导线中通过的电子的物质的量是0.2mol.
(3)一定温度下,将3molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为0.2mol/(L•min);X为2.若反应经2min达到平衡,平衡时C的浓度小于0.8mol/L(填“大于,小于或等于”).
(1)已知反应2H2+O2=H2O为放热反应,下图能正确表示该反应中能量变化的是A.

从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)原电池可将化学能转化为电能.将质量相
同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是Zn,正极的反应式为Cu2++2e-=Cu,电解质溶液中SO42- 移向负极(填“正”或“负”).一段时间后,取出洗净、干燥、称量,二者质量差为12.9g.则导线中通过的电子的物质的量是0.2mol.
(3)一定温度下,将3molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为0.2mol/(L•min);X为2.若反应经2min达到平衡,平衡时C的浓度小于0.8mol/L(填“大于,小于或等于”).
20. 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:增大乙醇浓度、移去生成物等.
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为原料来不及反应就被蒸出、温度过高发生副反应等.
(3)此反应以浓硫酸为催化剂,可能会造成产生大量酸性废液污染环境、部分原料炭化等问题.
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合).
①根据表中数据,下列C (填字母)为该反应的最佳条件.
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能为乙醇脱水生成乙醚.
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:(1)欲提高乙酸的转化率,可采取的措施有:增大乙醇浓度、移去生成物等.
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为原料来不及反应就被蒸出、温度过高发生副反应等.
(3)此反应以浓硫酸为催化剂,可能会造成产生大量酸性废液污染环境、部分原料炭化等问题.
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合).
| 同一反应时间 | 同一反应温度 | |||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* | |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 | |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 | |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 | |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 | |
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能为乙醇脱水生成乙醚.
10.在密闭容器中发生反应:aX(气)+bY(气)?cZ(气)+dW(气),反应达到平衡后,保持温度不变,将气体压缩到原来的$\frac{1}{2}$体积,当再次达到平衡时,W的浓度为原平衡的1.8倍,下列叙述中正确的是( )
| A. | 平衡常数K增大 | B. | a+b<c+d | C. | X的转化率下降 | D. | Z的体积分数增加 |
17.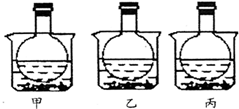 如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )
如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )
 如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )
如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )| A. | 甲烧瓶中气体颜色变浅 | B. | 乙烧瓶中气体颜色变深 | ||
| C. | 丙烧瓶中气体压强明显增大 | D. | 上述三种说法都不正确 |
14.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 达到化学平衡时,4 v正(O2)=5 v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到平衡时,若减小容器体积,则NH3的转化率会增大 |
15.化学源于生活又用于生活,下列有关应用不正确的是( )
| A. | 用浸泡高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯以达到保鲜效果 | |
| B. | 淀粉、油脂、蛋白质都是天然高分子化合物 | |
| C. | 加热能杀死流感病毒是因为病毒的蛋白质受热变性 | |
| D. | 含硫化石燃料的大量燃烧是酸雨形成的主要原因之一 |