题目内容
 第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行.
第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行.(1)体育馆内照明灯的导线大多数是铜导线,用铜做导线是利用金属铜的
(2)体育馆雄伟壮观的主体建筑使用了大量的金属铝板,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是
(3)本届锦标赛吉祥物“南南”和“宁宁”,其外材料为纯羊毛,内充PET纤维[化学式为C10H8O4].PET纤维由
考点:铜金属及其重要化合物的主要性质,铝的化学性质,合成材料
专题:化学应用
分析:(1)根据金属的物理性质分析解答;
(2)铝在空气中与氧气反应生成氧化铝;
(3)PET纤维的化学式为C10H8O4分析解答.
(2)铝在空气中与氧气反应生成氧化铝;
(3)PET纤维的化学式为C10H8O4分析解答.
解答:
解:(1)用铜做导线是利用金属铜的延展性和导电性,故答案为:延展;导电;
(2)铝在空气中与氧气反应生成氧化铝,化学方程式为:4Al+3O2═2Al2O3,故答案为;4Al+3O2═2Al2O3;
(3)PET纤维的化学式为C10H8O4,所以由 C、H、O三种元素组成,故答案为:C、H、O.
(2)铝在空气中与氧气反应生成氧化铝,化学方程式为:4Al+3O2═2Al2O3,故答案为;4Al+3O2═2Al2O3;
(3)PET纤维的化学式为C10H8O4,所以由 C、H、O三种元素组成,故答案为:C、H、O.
点评:本题主要对基础知识的考查,和化学方程式的书写,比较容易.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
一定条件下,在体积为2L的密闭容器中,3molX和3mol Y发生反应:3X(g)+Y(g)═2Z(g),经60s达到平衡,生成0.4molZ.下列说法正确的是( )
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
B、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
| ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
| D、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 |
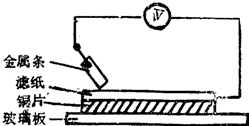 如图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧.在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表).下列说法中正确的是( )
如图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧.在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表).下列说法中正确的是( )| 金属 | 电子流动方向 | 电压 |
| A | A→Cu | +0.78 |
| B | Cu→B | -2.15 |
| C | C→Cu | +1.35 |
| D | +0.30 |
| A、金属D与Cu之间电子流动方向为Cu→D |
| B、A金属可能是最强的还原剂 |
| C、B金属不能从硫酸铜溶液中置换铜 |
| D、B金属可能是最强的还原剂 |
下列措施中肯定能使化学反应速率增大的是( )
| A、增大反应物的量 | B、增大压强 |
| C、降低温度 | D、升高温度 |
下列离子方程式中正确的是( )
| A、稀硫酸与氢氧化钡溶液反应Ba2++SO42-=BaSO4↓ |
| B、铝与氢氧溶液化钠反应Al+2OH-=AlO2-+H2↑ |
| C、向Na2CO3浓溶液中缓慢滴加几滴稀盐酸CO32-+H+=HCO3- |
| D、锌粒与稀醋酸反应Zn+2H+=Zn2++H2↑ |
下列配制的溶液浓度偏高的是( )
| A、配制硫酸用量筒量取硫酸时俯视刻度线 |
| B、配制盐酸定容时,仰视容量瓶刻度线 |
| C、NaOH溶解后未经冷却即注入容量瓶至刻度线 |
| D、称量4gNaOH配制0.1mol/L NaOH溶液1000ml时,砝码错放左盘 |
 (1)选择下列物质:①MgCl2②金刚石③NH4Cl④KNO3⑤干冰⑥单质碘晶体,按要求填空.(填序号)
(1)选择下列物质:①MgCl2②金刚石③NH4Cl④KNO3⑤干冰⑥单质碘晶体,按要求填空.(填序号)