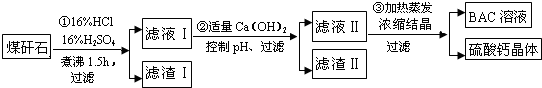
题目内容
下列配制的溶液浓度偏高的是( )
| A、配制硫酸用量筒量取硫酸时俯视刻度线 |
| B、配制盐酸定容时,仰视容量瓶刻度线 |
| C、NaOH溶解后未经冷却即注入容量瓶至刻度线 |
| D、称量4gNaOH配制0.1mol/L NaOH溶液1000ml时,砝码错放左盘 |
考点:溶液的配制
专题:实验评价题
分析:A、用量筒量取硫酸时俯视刻度线导致量取硫酸的体积偏小,所配溶液浓度偏低;
B、定容时仰视容量瓶刻度线,导致液体体积偏大,所配溶液浓度偏低;
C、NaOH溶解后未经冷却即注入容量瓶至刻度线,导致溶液体积偏小,所配溶液浓度偏高;
D、称量4gNaOH不用游码,因此称量质量准确,对溶液浓度无影响.
B、定容时仰视容量瓶刻度线,导致液体体积偏大,所配溶液浓度偏低;
C、NaOH溶解后未经冷却即注入容量瓶至刻度线,导致溶液体积偏小,所配溶液浓度偏高;
D、称量4gNaOH不用游码,因此称量质量准确,对溶液浓度无影响.
解答:
解:A、用量筒量取硫酸时俯视刻度线导致量取硫酸的体积偏小,所配溶液浓度偏低,故A错误;
B、定容时仰视容量瓶刻度线,导致液体体积偏大,所配溶液浓度偏低,故B错误;
C、NaOH溶解后未经冷却即注入容量瓶至刻度线,导致溶液体积偏小,所配溶液浓度偏高,故C正确;
D、称量4gNaOH不用游码,因此称量质量准确,对溶液浓度无影响,故D错误;
故选C.
B、定容时仰视容量瓶刻度线,导致液体体积偏大,所配溶液浓度偏低,故B错误;
C、NaOH溶解后未经冷却即注入容量瓶至刻度线,导致溶液体积偏小,所配溶液浓度偏高,故C正确;
D、称量4gNaOH不用游码,因此称量质量准确,对溶液浓度无影响,故D错误;
故选C.
点评:本题考查了一定物质的量浓度溶液配制实验的误差分析,难度不大,可根据c=
分析物质的量浓度的偏差.
| n |
| V |

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
下列反应的离子方程式书写正确的是 ( )
| A、氨气通入醋酸溶液中 CH3COOH+NH3═CH3COONH4 |
| B、澄清的石灰水跟盐酸反应 H++OH-═H2O |
| C、碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、金属钠跟水反应 2Na+2H2O═2Na++2OH-+H2↑ |
下列说法正确的是( )
| A、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| B、乙醇和油脂都能与氢氧化钠溶液反应 |
| C、淀粉、纤维素化学式均为(C6H10O5)n,互为同分异构体 |
| D、乙烯和苯均能与溴水发生加成反应 |
结构简式为(CH3)3CCH2CH3的烷烃,进行二氯取代反应后,生成的二氯取代产物有( )(不考虑立体异构)
| A、6种 | B、7种 | C、8种 | D、9种 |
下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A、常温下,28gFe与足量的浓硝酸反应,转移的电子数为1.5NA |
| B、标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2 |
| C、3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA |
| D、常温常压下,0.1mol氖气含有的电子数为NA |
 已知一个碳原子上连有两个羟基时,易发生下列转化:
已知一个碳原子上连有两个羟基时,易发生下列转化: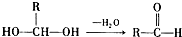
 第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行.
第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行.