题目内容
1.某溶液中存在大量的H+、SO42-、Cl-,该溶液中还可能大量存在的离子是( )| A. | OH- | B. | Ba2+ | C. | NO3- | D. | CO32- |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,以此来解答.
解答 解:某溶液中存在大量的H+、SO42-、Cl-,
A.H+、OH-结合生成水,不能大量共存,故A错误;
B.SO42-、Ba2+结合生成沉淀,不能大量共存,故B错误;
C.NO3-离子与溶液中的离子之间不反应,可大量共存,故C正确;
D.CO32-与H+反应生成二氧化碳和水而不能大量共存,故D错误.
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意常见物质的溶解性,题目难度不大.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则△H=-(Ea-Eb)kJ•mol-1 | |
| B. | 某温度下,氯化钠在水中的溶解度是20g,则该温度下的饱和氯化钠溶液溶质的质量分数为20% | |
| C. | 将浓度为0.1 mol•L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{{c({F^-})}}{{c({H^+})}}$始终保持增大 | |
| D. | 将0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
16.下列叙述不正确的是( )
| A. | 低碳生活(low-carbon life)是一种时尚的生活理念,倡导减少温室气体排放,CO2、CH4等是常见的温室气体 | |
| B. | 新型无机非金属材料用途广泛,人造刚玉用做高温炉管、氮化硅陶瓷可用于制造柴油机发动机部件 | |
| C. | 推广可利用太阳能、风能的城市照明系统,积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料,利于发展低碳经济、循环经济 | |
| D. | “显世闻名”的奶粉事件中污染物为三聚氰胺(结构如图),其摩尔质量为126g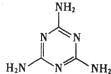 |
13.下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. | 利用A装置,若A为浓醋酸、B为碳酸钠(粉状)、C为苯酚钠溶液,一定能验证醋酸、碳酸、苯酚酸性的强弱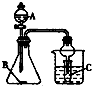 | |
| B. | 利用B装置可以完成乙酸乙酯制取实验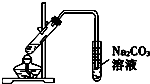 | |
| C. | 利用C装置可以完成石油蒸馏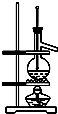 | |
| D. | 利用D装置可以完成实验室制乙烯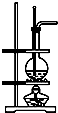 |
10.某有机物的分子式为C9H12,其属于芳香烃的同分异构体有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
 硝基还原为氨基:
硝基还原为氨基: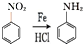
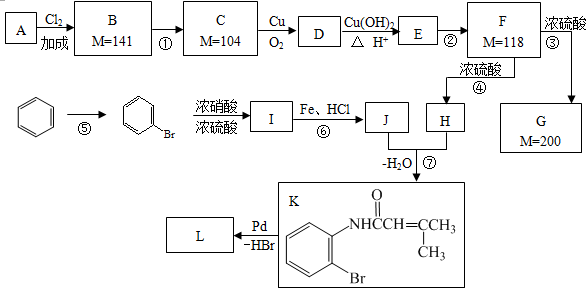
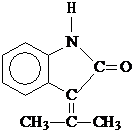 .
.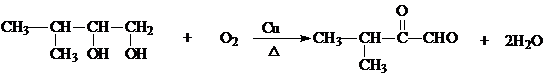 .
. .
.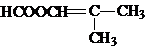 .
.