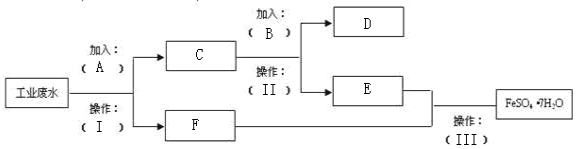
题目内容
5.下列叙述不正确的是( )| A. | 雾是气溶胶,在阳光下可观察到丁达尔效应 | |
| B. | 预制备Fe(OH)3胶体,向盛有沸水的烧杯中加入FeCl3饱和溶液煮沸得红褐色沉淀 | |
| C. | 用石膏或卤水点制豆腐利用了胶体的性质 | |
| D. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐 |
分析 A、雾是胶体;
B、根据氢氧化铁胶体的制备方法来分析;
C、胶体遇电解质溶液能发生胶体的聚沉;
D、鸡蛋壳膜是半透膜.
解答 解:A、雾是胶体,故有丁达尔效应,故在阳光照射下有通路,故A正确;
B、氢氧化铁胶体的制备方法是将饱和的氯化铁溶液滴入沸水中,继续煮沸至溶液呈现红褐色,若得到的是红褐色沉淀,则发生了胶体的聚沉,故B错误;
C、胶体遇电解质溶液能发生胶体的聚沉,而豆浆是胶体,石膏和卤水均为电解质溶液,故可以用于点豆腐,是利用了胶体的性质,故C正确;
D、鸡蛋壳膜是半透膜,只能允许小分子和小离子通过,故可以出去淀粉胶体中的食盐,故D正确.
故选B.
点评 本题考查了胶体的制备方法和胶体的性质,难度不大,应注意胶体性质的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.“混盐”是指一种金属离子与多种酸根离子构成的盐,氯化硝酸钙[Ca(NO3)Cl]就是一种混盐.“复盐”是指含有两种或者两种以上金属阳离子和一种酸根离子构成的盐如KA1(SO4)2•12H2O.下列化合物中属于混盐的是( )
| A. | CaOCl2 | B. | (NH4)2Fe(SO4)2 | C. | Na3A1F6 | D. | Cu2(OH)2CO3 |
16.已知:
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2.
则下列判断正确的是( )
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2.
则下列判断正确的是( )
| A. | 氧化性:MnO4-<Cl2<Fe3+<I2 | |
| B. | 还原性:Fe2+>I->Cl- | |
| C. | FeCl3能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 反应①中只体现盐酸的还原性 |
13.在100mL2mol/L的盐酸反应中分别加入等物质的量的金属Na、Mg、Al,充分生成气体的体积均为VL(标准状况下),下列说法正确的是( )
| A. | 反应中,每生成1molH2转移的电子数均为2mol | |
| B. | 参加反应的金属Na、Mg、Al的物质的量之比为1:2:3 | |
| C. | 镁的物质的量为0.1mol | |
| D. | V=2.24 |
20.对于化学反应能否自发进行,下列说法中错误的是( )
| A. | 若△H<0,△S>0,任何温度下都能自发进行 | |
| B. | 若△H>0,△S<0,任何温度下都不能自发进行 | |
| C. | 需要加热才能够进行的过程肯定不是自发过程 | |
| D. | 非自发过程在一定条件下可能变成自发过程 |
17.常温下,与100mL0.10mol/LMgCl2溶液中Cl-浓度相等的是( )
| A. | 200mL0.1mol/LKCl溶液 | B. | 200mL0.10mol/LNaCl溶液 | ||
| C. | 200 mL 0.10mol/LBaCl2溶液 | D. | 100mL0.1mol/LAl2(SO4)3溶液 |
3.下列图示与对应的叙述相符的是( )
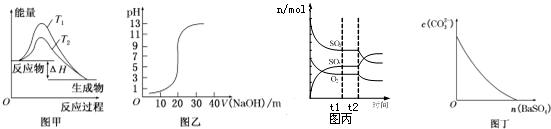

| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00ml 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)浓度变化 |