题目内容
28g铁与足量的稀盐酸完全反应,最多可收集多少体积的氢气(标准状况)?消耗的HCl的物质的量是多少?
考点:化学方程式的有关计算,铁的化学性质
专题:计算题
分析:根据n=
计算28g Fe的物质的量,根据方程式:Fe+2 HCl=FeCl2+H2↑计算生成氢气、消耗HCl的物质的量,再根据V=nVm计算氢气的体积.
| m |
| M |
解答:
解:28g Fe的物质的量=
=0.5mol
Fe+2 HCl=FeCl2+H2↑
1 2 1
0.5mol x y
所以x=
=1mol
y=
=0.5mol
故标况下,生成氢气的体积=0.5mol×22.4L/mol=11.2L,
答:标准状况下最多可以收集到11.2L气体,消耗的HCl的物质的量为1mol.
| 28g |
| 56g/mol |
Fe+2 HCl=FeCl2+H2↑
1 2 1
0.5mol x y
所以x=
| 0.5mol×2 |
| 1 |
y=
| 0.5mol×1 |
| 1 |
故标况下,生成氢气的体积=0.5mol×22.4L/mol=11.2L,
答:标准状况下最多可以收集到11.2L气体,消耗的HCl的物质的量为1mol.
点评:本题考查化学方程式的有关计算,难度不大,侧重对基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
短周期元素W、X、Y、Z的原子序数依次增大,W与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,Z原子的最外层电子数等于其最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )
| A、元素Y的气态氢化物比W的稳定 |
| B、元素Y的最高正价与负价绝对值的和等于8 |
| C、化合物XY2与ZY2分子中的化学键类型相同 |
| D、原子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) |
 液,试画出原电池的装置图,并说明其工作原理.
液,试画出原电池的装置图,并说明其工作原理.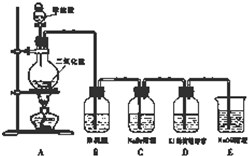 某校研究性学习小组设计实验,制取氯气以探究Cl2、Br2、I2的氧化性强弱(制取氯气的化学方程式为:MnO2+4HCl(浓)
某校研究性学习小组设计实验,制取氯气以探究Cl2、Br2、I2的氧化性强弱(制取氯气的化学方程式为:MnO2+4HCl(浓)