题目内容
X、Y、Z、W是四种核电荷数不超过18的元素.工业上通过蒸馏空气得到X的单质;Y是地壳中含量最多的金属元素;Z的单质在标况下的密度为3.17g/L.W的氢氧化物是一种中学化学中常见的强碱.回答下列问题:
(1)写出下列元素的元素符号.Y ;W ;
(2)画出X2-离子的结构示意图 .
(3)X、Y组成的化合物与W的氢氧化物反应的离子方程式 .
(4)用双线桥表示化合物W2X2与水反应的电子转移情况 .
(5)写出工业上制取Z单质的化学方程式 .
(1)写出下列元素的元素符号.Y
(2)画出X2-离子的结构示意图
(3)X、Y组成的化合物与W的氢氧化物反应的离子方程式
(4)用双线桥表示化合物W2X2与水反应的电子转移情况
(5)写出工业上制取Z单质的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是四种核电荷数不超过18的元素,均处于短周期.工业上通过蒸馏空气得到X的单质,由问题(2)中可以形成X2-离子,则X为O元素;Y是地壳中含量最多的金属元素,则Y为Al;Z的单质在标况下的密度为3.17g/L,其相对分子质量为22.4×3.17=71,则Z为Cl;W的氢氧化物是一种中学化学中常见的强碱,则W为Na,据此解答.
解答:
解:X、Y、Z、W是四种核电荷数不超过18的元素,均处于短周期.工业上通过蒸馏空气得到X的单质,由问题(2)中可以形成X2-离子,则X为O元素;Y是地壳中含量最多的金属元素,则Y为Al;Z的单质在标况下的密度为3.17g/L,其相对分子质量为22.4×3.17=71,则Z为Cl;W的氢氧化物是一种中学化学中常见的强碱,则W为Na,
(1)由上述分析可知,Y为Al,W为Cl,故答案为:Al;Cl;
(2)O2-离子的结构示意图为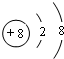 ,故答案为:
,故答案为: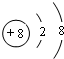 ;
;
(3)X、Y组成的化合物为Al2O3,W的氢氧化物为NaOH,氧化铝与氢氧化钠反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)用双线桥表示化合物Na2O2与水反应的电子转移情况为: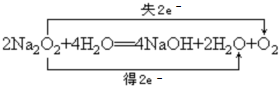 ,
,
故答案为: ;
;
(5)工业用电解饱和食盐水的方法制备氯气,反应方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
(1)由上述分析可知,Y为Al,W为Cl,故答案为:Al;Cl;
(2)O2-离子的结构示意图为
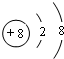 ,故答案为:
,故答案为: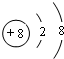 ;
;(3)X、Y组成的化合物为Al2O3,W的氢氧化物为NaOH,氧化铝与氢氧化钠反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)用双线桥表示化合物Na2O2与水反应的电子转移情况为:
 ,
,故答案为:
 ;
;(5)工业用电解饱和食盐水的方法制备氯气,反应方程式为:2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
点评:本题考查结构性质位置关系应用,侧重对常用化学用语的考查,(4)中电子转移表示为易错点,学生容易认为NaOH为还原产物,难度不大.

练习册系列答案
相关题目
下列实验装置进行的相应实验,能达到实验目的是( )
A、 装置甲可用于检验有乙烯生成 装置甲可用于检验有乙烯生成 |
B、 装置乙可用于收集和吸收氨气 装置乙可用于收集和吸收氨气 |
C、 装置丙可用于除去Cl2中混有的HCl气体 装置丙可用于除去Cl2中混有的HCl气体 |
D、 装置丁可分离CH3COOC2H5和饱和碳酸钠溶液 装置丁可分离CH3COOC2H5和饱和碳酸钠溶液 |


 3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析.
3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析.