题目内容
X、Y、Z、W为四种短周期元素.X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,
W的常见化合价为+3.回答下列问题:
(1)Z的原子结构示意图为 .
(2)X2-、Y-、W3+离子半径的大小顺序 .
(3)Y的气态氢化物与氨气在空气中相遇有白烟生成,产物中所含化学键为 .
(4)工业上常用碳高温下还原ZX2获得Z.写出该反应的化学方程式,并用单线桥法标出电子转移的方向与数目 .
(5)将W单质与少量的NaOH溶液混合,反应的离子方程式为 .
W的常见化合价为+3.回答下列问题:
(1)Z的原子结构示意图为
(2)X2-、Y-、W3+离子半径的大小顺序
(3)Y的气态氢化物与氨气在空气中相遇有白烟生成,产物中所含化学键为
(4)工业上常用碳高温下还原ZX2获得Z.写出该反应的化学方程式,并用单线桥法标出电子转移的方向与数目
(5)将W单质与少量的NaOH溶液混合,反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:
分析:X、Y、Z、W为四种短周期元素.X原子最外层电子数是核外电子层数的3倍,则X的电子层数为2,最外层电子为6,所以X为O;
Z在地壳中的含量仅次于氧,即Z为Si;Y、Z、W同周期,Y最高正价与最低负价的代数和为6,其最高正价为+7,所以Y为Cl;
W的常见化合价为+3,所以W为第三周期第ⅢA族元素,即W为Al,然后结合元素及其单质、化合物的性质来解答.
Z在地壳中的含量仅次于氧,即Z为Si;Y、Z、W同周期,Y最高正价与最低负价的代数和为6,其最高正价为+7,所以Y为Cl;
W的常见化合价为+3,所以W为第三周期第ⅢA族元素,即W为Al,然后结合元素及其单质、化合物的性质来解答.
解答:
解:X、Y、Z、W为四种短周期元素.X原子最外层电子数是核外电子层数的3倍,则X的电子层数为2,最外层电子为6,所以X为O;
Z在地壳中的含量仅次于氧,即Z为Si;Y、Z、W同周期,Y最高正价与最低负价的代数和为6,其最高正价为+7,所以Y为Cl;
W的常见化合价为+3,所以W为第三周期第ⅢA族元素,即W为Al,
(1)Z为Si元素,硅原子的原子序数水为14,其结构示意图为: ,
,
故答案为: ;
;
(2)电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,所以O2-、Cl-、Al3+离子半径的大小顺序为:Cl->O2->Al3+,
故答案为:Cl->O2->Al3+;
(3)Y的气态氢化物与氨气在空气中相遇有白烟生成,该白烟为氯化铵,氯化铵中含有离子键和共价键,故答案为:离子键、共价键;
(4)二氧化硅与C反应生成硅和CO,该反应中转移4e-,用单线桥法标出电子转移的方向与数目为: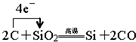 ,
,
故答案为: ;
;
(5)W为Al元素,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
Z在地壳中的含量仅次于氧,即Z为Si;Y、Z、W同周期,Y最高正价与最低负价的代数和为6,其最高正价为+7,所以Y为Cl;
W的常见化合价为+3,所以W为第三周期第ⅢA族元素,即W为Al,
(1)Z为Si元素,硅原子的原子序数水为14,其结构示意图为:
 ,
,故答案为:
 ;
;(2)电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,所以O2-、Cl-、Al3+离子半径的大小顺序为:Cl->O2->Al3+,
故答案为:Cl->O2->Al3+;
(3)Y的气态氢化物与氨气在空气中相遇有白烟生成,该白烟为氯化铵,氯化铵中含有离子键和共价键,故答案为:离子键、共价键;
(4)二氧化硅与C反应生成硅和CO,该反应中转移4e-,用单线桥法标出电子转移的方向与数目为:
 ,
,故答案为:
 ;
;(5)W为Al元素,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评:本题考查位置、结构与性质的关系的应用,题目难度中等,元素的推断为解答本题的关键,并熟悉元素化合物的性质、氧化还原反应、化学键等知识来解答,试题综合性较强,充分考查了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
如表为元素周期表中短周期的一部分.下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )

| A、A与B形成的阴离子可能有:AB32-、A2B42- |
| B、E的氢化物的沸点比C的氢化物的沸点高 |
| C、D在过量的B中燃烧的主要产物为DB2 |
| D、A与E形成的化合物是非极性分子 |
 某晶体中含有A、B、C三种元素,其晶胞排列方式如图所示,晶体中A、B、C的原子个数之比依次为( )
某晶体中含有A、B、C三种元素,其晶胞排列方式如图所示,晶体中A、B、C的原子个数之比依次为( )| A、1:3:1 |
| B、2:3:1 |
| C、8:6:1 |
| D、4:3:1 |
下列指定反应的离子方程式正确的是( )
| A、向 苯粉钠溶液中通入少量的CO2:2C6H5O+CO2+H2O→2C6H5OH+CO32- | ||||
| B、铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+2H2↑ | ||||
| C、NH4HSO4和过量的氧化钠溶液反应:NH4++OH-═NH3H2O | ||||
D、用惰性电极电解硫酸铜溶液:2C2++2H2O
|
 A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.
A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心. 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.