题目内容
4.观察下列模型并结合相关信息,判断下列说法中不正确的是( )| B12结构单元 | SF6 | S8 | HCN |
 |  |  |  |
| 熔点1873K | 气体 | 易溶于CS2 | 溶液显弱酸性 |
| A. | 单质B12形成的晶体可能为原子晶体 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | S8和HCN形成晶体后,晶体类型相同 | |
| D. | HCN形成晶体后,晶体中的作用力只有共价键 |
分析 A.B12结构单为空间网状结构,熔点较高,为原子晶体的性质;
B、SF6空间构型为对称结构,含S-F极性键,分子极性抵消;
C、根据晶体中存在的微粒判断;
D.HCN为分子晶体,形成晶体的作用力为范德华力,分子内部存在共价键.
解答 解:A.由图知,B12结构单为空间网状结构,熔点较高,可能为原子晶体,故A正确;
B.SF6空间构型为对称结构分子极性抵消,正负电荷的重心重合,电荷分布均匀,是由S-F极性键形成的非极性分子,故B正确;
C.固态S是由S8构成的,该晶体中存在的微粒是分子,所以属于分子晶体,HCN属于酸,其晶体为分子晶体,故C正确;
D.HCN为分子晶体,形成晶体的作用力为范德华力,分子内部存在共价键,故D错误.
故选D.
点评 本题考查微粒的结构示意图(比例、球棍模型、结构式),注意根据物质的结构和性质分析物质所述晶体类型,根据结构判断所含化学键类型及分子的极性,题目难度不大.

练习册系列答案
相关题目
12.氢气还原氧化铜:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,该反应中( )
| A. | H2作氧化剂 | B. | 铜元素化合价升高 | ||
| C. | 氢元素化合价降低 | D. | Cu是还原产物 |
19.下列叙述正确的是( )
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 原电池是自发的氧化还原反应,电解池发生的是不自发的氧化还原发应 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量大 | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
16.对于下列有机物,说法中正确的是( )


| A. | 它是苯酚的同系物 | |
| B. | 1mol该有机物能与溴水反应消耗2molBr2发生取代反应 | |
| C. | 1mol该有机物能与金属钠反应产生0.5molH2 | |
| D. | 1mol该有机物能与2molNaOH反应 |
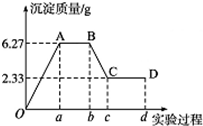 下面是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag +、Ca2+、Cl-、CO32-和SO42-中的若干种,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1.0mol•L-1的硝酸,实验过程中沉淀质量的变化如图所示:
下面是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag +、Ca2+、Cl-、CO32-和SO42-中的若干种,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1.0mol•L-1的硝酸,实验过程中沉淀质量的变化如图所示: