题目内容
18.在25℃下,已知反应:①NH3•H2O+H+?NH4++H2O(平衡常数为K1);
②Ag++2NH3•H2O?Ag(NH3)2++2H2O(平衡常数为K2),且K1>K2.
下列说法不合理的是( )
| A. | 25℃时,将0.02 mol•L-1的氨水与a mol•L-1的盐酸等体积混合(体积变化忽略不计),反应后溶液呈中性,则用含a的代数式表示NH3•H2O的电离常数为Kb=$\frac{a×1{0}^{-7}}{0.02-a}$ | |
| B. | 往银氨溶液中加水稀释,反应②平衡向逆反应方向移动 | |
| C. | 若往银氨溶液中加入足量的盐酸,则溶液中会产生白色浑浊 | |
| D. | 已知:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 L 0.1 mol•L-1氨水和足量的盐酸反应放出的热量等于5.73 kJ |
分析 A.呈中性则c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=$\frac{a}{2}$mol/L,以此计算;
B.根据浓度对平衡的影响分析;
C.盐酸与氨水反应生成氯化铵,氯离子与银离子结合生成AgCl沉淀;
D.氨水中NH3•H2O电离时吸热,1molNH3•H2O与HCl反应放出的热量小于57.3kJ.
解答 解:A.呈中性则c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=$\frac{a}{2}$mol/L,所以用含a的代数式表示NH3•H2O的电离常数为Kb=$\frac{c(O{H}^{-})×c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×\frac{a}{2}}{0.01-\frac{a}{2}}$=$\frac{a×1{0}^{-7}}{0.02-a}$,故A正确;
B.往银氨溶液中加水稀释,生成物水增加,则反应②平衡向逆反应方向移动,故B正确;
C.盐酸与氨水反应生成氯化铵,氯离子与银离子结合生成AgCl沉淀,所以若往银氨溶液中加入足量的盐酸,则溶液中会产生白色浑浊,故C正确;
D.氨水中NH3•H2O电离时吸热,1molNH3•H2O与HCl反应放出的热量小于57.3kJ,则1 L 0.1 mol•L-1氨水,即0.1molNH3•H2O和足量的盐酸反应放出的热量小于5.73 kJ,故D错误.
故选D.
点评 本题考查了电离常数的计算、化学平衡移动、中和热等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,注意把握电离常数的计算方法,题目难度中等.

练习册系列答案
相关题目
8.下列各组离子在无色酸性溶液中可以大量共存的有( )
| A. | Ag+、K+、NO3-、Cl- | B. | K+、Cu2+、SO42-、HCO3- | ||
| C. | Mg2+、Cl-、SO42-、Na+ | D. | CO32-、K+、NO3-、Na+ |
9.无法将氯化钠、碘化钾两种溶液鉴别开来的试剂或方法是( )
| A. | 硝酸银溶液 | B. | 淀粉溶液 | C. | 焰色反应 | D. | Br2的CCl4溶液 |
6.下列物质的水溶液因水解而呈碱性的是( )
| A. | Ba(OH)2 | B. | FeCl3 | C. | NaHSO4 | D. | CH3COONa |
13.下列各组微粒在指定的环境中一定大量存在的是( )
| A. | 与铝反应产生H2的溶液中:Na+、K+、S2-、CO32- | |
| B. | 加入酚酞显红色的溶液中:K+、Na+、Cl-、CH3COO- | |
| C. | pH=2的溶液中:NH4+、Na+、Fe2+、NO3-、Cl- | |
| D. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Na+、Cl-、Al3+ |
3.下列说法不正确的是( )
| A. | 外界条件相同时,放热反应的速率一定大于吸热反应的速率 | |
| B. | 化学反应中的能量变化可表现为热量的变化 | |
| C. | 反应物的总能量高于生成物的总能量时,发生放热反应 | |
| D. | CaO+H2O═Ca(OH)2反应过程中,旧键断裂吸收的能量小于新键形成释放的能量 |
10.常温下,在c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol•L-1的溶液中,H2CO3、HCO3-、CO32-的物质的量的百分含量随pH的变化如图所示.下列说法错误的是( )
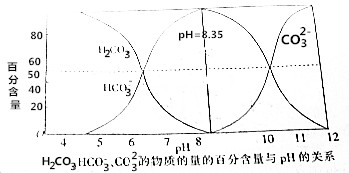

| A. | 碳酸溶液中:c(H+)>c(HCO3-) | |
| B. | pH=8.35的钠盐溶液中:c(H2CO3)+c(H+)=c(CO32-)+c(OH-) | |
| C. | 在Na2CO3和NaHCO3的混合溶液中,若c(CO32-)=c(HCO3-),则c(Na+)+c(H+)=3c(HCO3-)+c(OH-) | |
| D. | pH=12的钠盐溶液中:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
7.某羧酸酯的分子式为C18H26O4,1mol该酯完全水解可得到2mol某羧酸和1mol乙二醇,羧酸的分子式为( )
| A. | C8H16O2 | B. | C8H14O2 | C. | C8H12O2 | D. | C8H10O2 |
