题目内容
6.下列物质的性质比较,正确的是( )| A. | 气态氢化物稳定性:HF>HCl | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>Cl | D. | 酸性:H2SO4>HClO4 |
分析 A.非金属性越强,气态氢化物越稳定;
B.金属性越强,其最高价氧化物对应水化物的碱性越强;
C.同周期从左到右,非金属性逐渐增强;
D.非金属性越强,其最高价氧化物对应水化物的酸性越强.
解答 解:A.因非金属性F>Cl,则稳定性HF>HCl,故A正确;
B.因金属性K>Na,则碱性NaOH<KOH,故B错误;
C.同周期从左到右,非金属性逐渐增强,因此非金属性P<Cl,故C错误;
D.因非金属性Cl>S,则酸性H2SO4<HClO4,故D错误;
故选A.
点评 本题考查元素周期表和元素周期律,为高频考点,把握同周期和同主族元素的性质变化规律、金属性与非金属性强弱的比较方法是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
16. 分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
 分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )| A. | 12种 | B. | 10种 | C. | 9种 | D. | 6种 |
17.下列各项判断完全正确的是( )
| 变化 | △H | △S | 方向性 | |
| A | H2O(l)→H2O(g) | >0 | <0 | 非自发 |
| B | 2NO2(g)?N2O4(g) | <0 | <0 | 自发 |
| C | 2Fe3+(aq)+Cu(s)=2Fe2+(aq)+Cu2+(aq) | >0 | >0 | 自发 |
| D | NH4Cl(s)=NH3(g)+HCl(g) | <0 | >0 | 非自发 |
| A. | A | B. | B | C. | C | D. | D |
14.某共价化合物含C、H、N三种元素,分子内有4个N原子,且4个N原子排列成空间的四面体(如白磷分子结构),每2个N原子之间都有一个C原子,分子内无碳碳单键和碳碳双键,则该化合物分子式为( )
| A. | C4H8N4 | B. | C6H12N4 | C. | C6H10N4 | D. | C4H10N4 |
1.四种短周期元素XYZW在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
(1)这些元素的氢化物中,水溶液碱性最强的是 (写电子式);
(写电子式);
(2)XW2的结构式为S=C=S;
(3)Y、Z的氢化物稳定性由强到弱的是NH3>PH3;(用化学式表示)
(4)FeCl2溶液滴加Y的最高价氧化物的水化物,写出该反应的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)T元素在周期表中位置第四周期第VIA;T元素最高正价与最低负价的绝对值之差为4.
(6)含W、Y两元素的含氧酸正盐A,既于HCl反应,也与NaOH 反应,则A的化学式为(NH4)2SO3.
| X | Y | |
| Z | W | |
| T |
 (写电子式);
(写电子式);(2)XW2的结构式为S=C=S;
(3)Y、Z的氢化物稳定性由强到弱的是NH3>PH3;(用化学式表示)
(4)FeCl2溶液滴加Y的最高价氧化物的水化物,写出该反应的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)T元素在周期表中位置第四周期第VIA;T元素最高正价与最低负价的绝对值之差为4.
(6)含W、Y两元素的含氧酸正盐A,既于HCl反应,也与NaOH 反应,则A的化学式为(NH4)2SO3.
11.下列说法中错误的是( )
| A. | 天然气是一种清洁的化石燃料 | |
| B. | 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等 | |
| C. | 煤是由有机物和无机物组成的复杂的混合物 | |
| D. | 石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |
18.青蒿酸是合成青蓠素的原科,其可以由香草醛合成:下列叙述正确的是( )
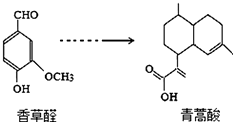

| A. | 在一定条件,香草醛可与HCHO发生缩聚反应 | |
| B. | 两种物质各1mol分别和氢气反应,最多消耗氢气4mol和3mol | |
| C. | 用FeCl3溶液可鉴别化合物香草醛和青蒿酸 | |
| D. | 青蒿酸分子中含有2个手性碳原子 |
16.下列各组物质中,所含化学键类型完全相同的是( )
| A. | HCl和MgCl2 | B. | H2O和CO2 | C. | Ar和CCl4 | D. | NH4Cl和Na2O |

