题目内容
1.四种短周期元素XYZW在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.| X | Y | |
| Z | W | |
| T |
 (写电子式);
(写电子式);(2)XW2的结构式为S=C=S;
(3)Y、Z的氢化物稳定性由强到弱的是NH3>PH3;(用化学式表示)
(4)FeCl2溶液滴加Y的最高价氧化物的水化物,写出该反应的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)T元素在周期表中位置第四周期第VIA;T元素最高正价与最低负价的绝对值之差为4.
(6)含W、Y两元素的含氧酸正盐A,既于HCl反应,也与NaOH 反应,则A的化学式为(NH4)2SO3.
分析 短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,则(2+8+x)=3x,解得x=5,则Z为P;然后由元素周期表中的位置可知,X为C,Y为N,W为S,T为Se,然后结合元素及其单质、化合物的性质来解答.
解答 解:短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,则(2+8+x)=3x,解得x=5,则Z为P;然后由元素周期表中的位置可知,X为C,Y为N,W为S,
(1)上述元素的氢化物中,只有氨气的水溶液显碱性,氨气的化学式为NH3,其电子式为 ,
,
故答案为: ;
;
(2)X为C,其最外层4个电子,W为S,其最外层6个电子,XW2的电子式为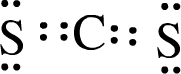 ,结构式为S=C=S,
,结构式为S=C=S,
故答案为:S=C=S;
(3)非金属性越强,氢化物越稳定,则稳定性为NH3>PH3,故答案为:NH3>PH3;
(4)FeCl2溶液滴加Y的最高价氧化物的水化物硝酸,该反应的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(5)T为Se,位于第四周期第VIA;最高正价为+6价,最低价为-2价,则T元素最高正价与最低负价的绝对值之差为4,故答案为:第四周期第VIA;4;
(6)含W、Y两元素的含氧酸正盐A,既于HCl反应,也与NaOH 反应,为亚硫酸对应的铵盐,则A的化学式为(NH4)2SO3,故答案为:(NH4)2SO3.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,明确Z的原子结构关系推断元素是解答本题的关键,注意利用位置及电子数的关系来计算确定Z,并熟悉物质的性质来解答即可,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列措施或叙述不合理的是( )
| A. | 用SO2漂白纸浆和草帽辫 | |
| B. | SO2具有强还原性,浓硫酸具有强氧化性,故浓硫酸不能用于干燥SO2气体 | |
| C. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 | |
| D. | Na2SO3与H2O2的反应为氧化还原反应 |
6.下列物质的性质比较,正确的是( )
| A. | 气态氢化物稳定性:HF>HCl | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>Cl | D. | 酸性:H2SO4>HClO4 |
13.下列有关新型有机高分子材料的说法中,不正确的是( )
| A. | 导电塑料是应用于电子工业的一种新型有机高分子材料 | |
| B. | 复合材料一般是以一种材料作基体,另一种材料作为增强体 | |
| C. | 高分子分离膜应用于食品工业中,可用子浓缩天然果汁、乳制品加工、酿造业等 | |
| D. | 合成高分子材料制成的人工器官都会受到人体的排斥作用,难以达到生物相容的程度 |
11.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4 kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭恒容容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04 mol•L-1;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
③下列措施中能说明反应达到平衡状态的是D
A.体系压强保持不变 B.混合气体的密度保持不变
C.CH3OH与H2O的浓度之比为1:2
D.单位时间内,消耗2mol CH3OH的同时消耗1molH2O.
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4 kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭恒容容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04 mol•L-1;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
③下列措施中能说明反应达到平衡状态的是D
A.体系压强保持不变 B.混合气体的密度保持不变
C.CH3OH与H2O的浓度之比为1:2
D.单位时间内,消耗2mol CH3OH的同时消耗1molH2O.
 ;C22-(电子式)
;C22-(电子式) ;1,3-丁二烯(实验式)C2H3.
;1,3-丁二烯(实验式)C2H3.
 .
. ..
.. 、
、 .
.