题目内容
8.用NA代表阿伏加德罗常数的值.下列叙述正确的是( )| A. | 28g乙烯中含有的电子总数为12NA | |
| B. | 1L0.1mol•L-1NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA | |
| C. | 用铅蓄电池电解氯化钠溶液,若收集到11.2LCl2(标准状况),则至少转移电子数为NA | |
| D. | H2与Cl2反应生成22.4LHCl(标准状况),则断裂化学键的总数为2NA |
分析 A.求出乙烯的物质的量,然后根据1mol乙烯中含16mol电子来分析;
B.酸根离子部分水解生成碳酸,部分电离生成碳酸根离子,依据原子个数守恒解答;
C.依据标况下产生氯气的体积计算氯气的物质的量,依据2Cl-~Cl2~2e-,计算解答;
D.H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,反应断裂1molH-H键和1molCl-Cl键时,生成2molHCl.
解答 解:A.28g乙烯的物质的量为1mol,而1mol乙烯中含16mol电子,即含16NA个,故A错误;
B.依据碳原子守恒,1L0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-、H2CO3之和等于0.1NA,1L0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和小于0.1NA,故B错误;
C.收集到11.2LCl2(标准状况)物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,则至少转移电子数为NA,故C正确;
D.H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,反应断裂1molH-H键和1molCl-Cl键时,生成2molHCl,故当生成标况下22.4L氯化氢即1molHCl时,断裂1mol化学键,即NA个,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量计算微粒数,气体摩尔体积的条件应用,注意盐溶液中物料守恒的运用,题目难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
18.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. | 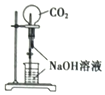 喷泉实验 | B. |  配制一定物质的量浓度的NaCl溶液 | ||
| C. | 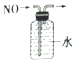 排水法收集NO | D. |  碳酸氢钠受热分解 |
19.下列说法正确的是( )
| A. | 向碳酸氢钠溶液中加入氢氧化钙溶液时,溶液没有浑浊 | |
| B. | 夏日的傍晚常常看到万丈霞光,该现象属于胶体的丁达尔效应 | |
| C. | 过氧化钠是一种强氧化剂,不可作为氧气来源 | |
| D. | 胶体和浊液的分散质都不能通过滤纸的孔隙 |
16.下列叙述正确的是( )
| A. | NO的摩尔质量为30g | |
| B. | 常温常压下,14g一氧化碳所占体积为11.2 L | |
| C. | 等物质的量的Na2O2和Na2O中所含阴阳离子总数相等 | |
| D. | 设阿伏加德罗常数为NA,常温常压下O2与O3的混合物32g,含有分子数为NA |
13.下列防止钢铁锈蚀的措施不合理的是 ( )
| A. | 在自行车的钢圈表面镀镍 | B. | 在地下钢铁管道上连接铜块 | ||
| C. | 改变金属内部结构制成不锈钢 | D. | 健身器村刷油漆或包上一层塑料层 |
1.向1LFeBr2溶液中,通入1.12L的Cl2,测得溶液中c(Br-)=3c(Cl-),反应过程中溶液的体积变化不计,则下列说法中正确的是( )
| A. | 原溶液的浓度为0.1mol/L | B. | 反应后溶液中c(Fe3+)=0.1mol/L | ||
| C. | 反应后溶液中c(Fe3+)=c(Fe2+) | D. | 原溶液中c(Br-)=0.4mol/L |
18.在化学实验操作中,往往由于读数不规范导致较大的实验误差.下列有关实验中,会导致所配制(或所测定)溶液浓度偏高的是(其他操作均正确)( )
| A. | 配制500 mL 1 mol/L稀硫酸实验中,用量筒量取18 mol/L 浓硫酸时俯视读数 | |
| B. | 配制100 mL 5 mol/L氯化钠溶液实验中,定容时仰视 | |
| C. | 用标准盐酸滴定待测NaOH溶液实验中,使用碱式滴定管开始平视,后来俯视读数 | |
| D. | 用标准NaOH溶液滴定待测盐酸实验中,使用碱式滴定管开始平视,后来俯视读数 |
19.下列物质的水溶液因水解而呈酸性的是( )
| A. | NaOH | B. | (NH4)2SO4 | C. | Na2CO3 | D. | NaCl |