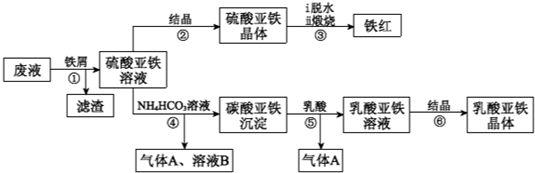
题目内容
7.下列物质在空气里完全燃烧,生成二氧化碳和水的物质的量之比为1:1的有( )| A. | 甲醇 | B. | 乙炔 | C. | 乙醇 | D. | 乙醛 |
分析 有机物完全燃烧生成二氧化碳和水的物质的量之比为1:1,则碳、氢原子个数之比是1:2,以此解答该题.
解答 解;有机物完全燃烧生成二氧化碳和水的物质的量之比为1:1,则碳、氢原子个数之比是1:2,
A.甲醇分子式为CH4O,碳氢原子个数之比是1:4,故A错误;
B.乙炔分子式为C2H2,碳氢原子个数之比是1:1,故B错误;
C.乙醇分子式为C2H6O,碳氢原子个数之比是1:3,故C错误;
D.乙醛分子式为C2H4O,碳氢原子个数之比是1:1,故D正确.
故选D.
点评 本题考查烃燃烧有关计算,侧重于学生的分析、计算能力的考查,利用原子守恒判断C、H原子数目之比,结合验证法判断,难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
12.下列离子在pH=1的溶液中能大量存在的是( )
| A. | HCO3- | B. | AlO2- | C. | SO32- | D. | Mg2+ |
16.借助碱金属和卤族元素的递变性分析下面的推断,其中正确的是( )
| A. | 已知Ca是第4周期、第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱 | |
| B. | 已知As是第4周期、第VA族的元素,故AsH3的稳定性比NH3的稳定性强 | |
| C. | 已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈 | |
| D. | 已知Cl的核电荷数比F的核电荷数大,故Cl的原子半比F的原子半径大 |
17.下列有关有机化合物的叙述正确的是( )
| A. | 植物油与聚乙烯均能使溴水褪色 | |
| B. | 淀粉与纤维素均为高分子化合物且互为同分异构体 | |
| C. | 蔗糖与麦芽糖的水解产物均为葡萄糖 | |
| D. | 丙烷与2-甲基丙烷的一氯代物均为两种 |
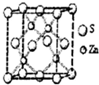 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答: