题目内容
3.高纯二氧化硅可用来制造光纤.某稻壳灰的成分为:| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
(已知:AlO2-+H++H2O=Al(OH)3↓)

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有3类.
(2)步骤①中涉及SiO2的离子反应方程式为SiO2+2OH-=SiO32-+H2O.
(3)滤渣A的成分有Fe2O3填化学式)
(4)步骤②洗涤时,检验是否洗涤干净的方法是?:取最后一次洗涤滤液,加硝酸银溶液,若无沉淀产生,则说明洗涤干净
(5)步骤③反应的化学方程式为:H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+SiO2;实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、坩埚和泥三角.
分析 稻壳灰用足量的氢氧化钠浸泡,过滤得A为硅酸钠溶液,硅酸钠溶液中加入盐酸生成硅酸沉淀,过滤、洗涤得滤渣B为硅酸,煅烧硅酸可得二氧化硅,
(1)二氧化硅为酸性氧化物,氧化钠、氧化钾、氧化铁为碱性氧化物,氧化铝为两性氧化物;
(2)二氧化硅为酸性氧化物,与氢氧化钠反应生成硅酸钠和水;
(3)氧化钠、氧化钾均能与水反应生成可溶性碱,氧化铝为两性氧化物能够与强碱反应生成可溶性偏铝酸盐,二氧化硅 为酸性氧化物与氢氧化钠反应生成可溶性硅酸钠,三氧化二铁与氢氧化钠不反应;
(4)硅酸不稳定受热易分解生成二氧化硅和水;
(5)依据灼烧固体实验选择合适装置.
解答 解:稻壳灰用足量的氢氧化钠浸泡,过滤得A为硅酸钠溶液,硅酸钠溶液中加入盐酸生成硅酸沉淀,过滤、洗涤得滤渣B为硅酸,煅烧硅酸可得二氧化硅,
(1)二氧化硅为酸性氧化物,氧化钠、氧化铁为碱性氧化物,氧化铝为两性氧化物,所以最多涉及3中氧化物;
故答案为:3;
(2)二氧化硅为酸性氧化物,与氢氧化钠反应生成硅酸钠和水,离子方程式:SiO2+2OH-=SiO32-+H2O;
故答案为:SiO2+2OH-=SiO32-+H2O;
(3)氧化钠、氧化钾均能与水反应生成可溶性碱,氧化铝为两性氧化物能够与强碱反应生成可溶性偏铝酸盐,二氧化硅 为酸性氧化物与氢氧化钠反应生成可溶性硅酸钠,三氧化二铁与氢氧化钠不反应,所以过滤剩余的滤渣为Fe2O3;
故答案为:Fe2O3;
(4)步骤②洗涤时,检验是否洗涤干净的方法是取最后一次洗涤滤液,加硝酸银溶液,若无沉淀产生,则说明洗涤干净,
故答案为:取最后一次洗涤滤液,加硝酸银溶液,若无沉淀产生,则说明洗涤干净;
(5)硅酸不稳定受热易分解生成二氧化硅和水,方程式:H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+SiO2,灼烧固体需要的仪器有:坩埚钳、酒精灯、三脚架、坩埚、泥三角;
故答案为:H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+SiO2;坩埚;泥三角.
点评 本题考查了硅及其化合物性质,熟悉氧化物的分类,明确硅及其化合物性质是解题关键,题目难度中等.

| A. |  25℃时,向亚硫酸溶液中通入氯气 | B. |  向 Na[Al(OH)4]溶液中通入 HCl气体 | ||
| C. |  向少量氯化铁溶液中加入铁粉 | D. |  向BaSO4饱和溶液中加入硫酸钠 |
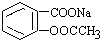 转变为
转变为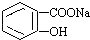 的方法是( )
的方法是( )| A. | 与足量Na0H溶液共热后,再通入CO2 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量Na0H溶液 | |
| D. | 足量稀硫酸共热后,加入足量NaHCO3 |
| A. | s区、d区、ds区都是金属元素 | B. | s区都是主族元素 | ||
| C. | 稀有气体元素在ds区 | D. | 所有非金属元素都在p区 |

 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题: 在25℃,101KPa的条件下,将共8L的CO和O2的混合气体通入一个带可自由移动活塞容积可变但压强不变的密闭容器中(如图所示),用电火花点燃充分反应后恢复至原来的条件,测得气体的密度变为原来的$\frac{4}{3}$,求
在25℃,101KPa的条件下,将共8L的CO和O2的混合气体通入一个带可自由移动活塞容积可变但压强不变的密闭容器中(如图所示),用电火花点燃充分反应后恢复至原来的条件,测得气体的密度变为原来的$\frac{4}{3}$,求 ,用电子式表示A与B形成的三原子分子的形成过程
,用电子式表示A与B形成的三原子分子的形成过程 .
.