题目内容
下列关于铷的叙述不正确的是( )
| A、金属铷投入水中会引起爆炸 |
| B、铷是一种强还原剂,铷离子很稳定 |
| C、铷受热后,能在空气中剧烈燃烧,生成比过氧化物更复杂的氧化物 |
| D、铷原子的核电荷数比钾原子的核电荷数多,因此铷原子失电子的能力小于钾原子 |
考点:碱金属的性质
专题:
分析:Rb属于碱金属族元素,位于Na元素下方,所以其金属性大于Na,
A.Rb与水反应比Na更剧烈;
B.金属元素单质的还原性越强,其简单阳离子氧化性越弱;
C.Rb金属性比K更强,能在空气中燃烧;
D.同一主族金属元素,其单质的还原性随着原子序数增大而增强,则失电子能力越强.
A.Rb与水反应比Na更剧烈;
B.金属元素单质的还原性越强,其简单阳离子氧化性越弱;
C.Rb金属性比K更强,能在空气中燃烧;
D.同一主族金属元素,其单质的还原性随着原子序数增大而增强,则失电子能力越强.
解答:
解:Rb属于碱金属族元素,位于Na元素下方,所以其金属性大于Na,
A.Rb与水反应比Na更剧烈,钠与水反应发出嘶嘶声音,则Rb和水反应会引起爆炸,故A正确;
B.金属元素单质的还原性越强,其简单阳离子氧化性越弱,Rb的还原性大于Na,则简单铷离子氧化性很弱,所以其简单离子很稳定,不易被还原,故B正确;
C.Rb金属性比K更强,能在空气中燃烧,K燃烧生成超氧化物,则Rb燃烧生成比过氧化物更复杂的氧化物,故C正确;
D.同一主族金属元素,其单质的还原性随着原子序数增大而增强,则失电子能力越强,所以铷原子失电子的能力大于钾原子,故D错误;
故选D.
A.Rb与水反应比Na更剧烈,钠与水反应发出嘶嘶声音,则Rb和水反应会引起爆炸,故A正确;
B.金属元素单质的还原性越强,其简单阳离子氧化性越弱,Rb的还原性大于Na,则简单铷离子氧化性很弱,所以其简单离子很稳定,不易被还原,故B正确;
C.Rb金属性比K更强,能在空气中燃烧,K燃烧生成超氧化物,则Rb燃烧生成比过氧化物更复杂的氧化物,故C正确;
D.同一主族金属元素,其单质的还原性随着原子序数增大而增强,则失电子能力越强,所以铷原子失电子的能力大于钾原子,故D错误;
故选D.
点评:本题考查碱金属族元素,明确同一主族元素性质递变规律是解本题关键,以碱金属族、卤族元素为例熟练掌握同一主族元素性质递变规律及其原因,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一定温度下,某容积不变的密闭容器中,不能说明可逆反应:C(s)+H2O(g)?CO(g)+H2(g)在一定条件下已达到化学平衡状态的是( )
| A、v正(CO)=v逆(H2O) |
| B、体系的压强不再发生变化 |
| C、生成n mol CO的同时生成n mol H2 |
| D、1 mol H-H键断裂的同时断裂2 mol H-O键 |
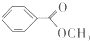 )是一种重要的工业有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.
)是一种重要的工业有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.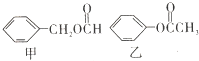
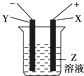 根据如图所示装置回答:
根据如图所示装置回答: