题目内容
2. Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题.
Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题.(1)运输氯气的钢瓶上应贴的标签为C.
A.腐蚀品 B.爆炸品 C.有毒品 D.易燃品
(2)工业上将氯气通入石灰乳制取漂白粉,写出该反应的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(3)漂白粉的有效成分是(填化学式)Ca(ClO)2.
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2.高锰酸钾溶液常用于物质的定性检验与定量分析.某化学兴趣小组在实验室里欲用KMnO4固体来配制500mL 0.1mol/L的KMnO4溶液.
①需用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、500ml容量瓶.
②下列操作会导致实验结果偏小的是a、c(填字母).
a.转移时没有洗涤烧杯、玻璃棒
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.加水定容时俯视刻度线
③用配好的该浓度的KMnO4溶液与300mL 0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的体积为320mL.(已知MnO4-在此条件被还原为Mn2+)
(5)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量,已知:Cl2+2Br-=2Cl-+Br2 ).
①能证明氯水具有漂白性的是d(填“a”、“b”、“c”或“d”),现象是.②a中发生反应的离子方程式是.
分析 (1)氯气为有毒的气体;
(2)工业上将氯气通入石灰乳制取漂白粉,生成Ca(ClO)2、CaCl2;
(3)漂白粉的主要成分为Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2;
(4)①依据配制一定物质的量浓度溶液的一般步骤选择需要仪器;
②分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
③n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,结合化合价的变化计算转移的电子的数目,可计算消耗KMnO4的物质的量;
(5)将氯气溶于水得到氯水(浅黄绿色),氯水含多种微粒,其中有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水微弱电离出来的).
解答 解:(1)氯气为有毒的气体,则①中钢瓶上应贴的标签为C,不易燃、易爆,本身不具有腐蚀性,故答案为:C;
(2)工业上将氯气通入石灰乳制取漂白粉,生成Ca(ClO)2、CaCl2,所以化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)漂白粉的主要成分为Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2,故答案为:Ca(ClO)2;
(4)①配制500mL 0.1mol/L的KMnO4溶液溶液的步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、500ml容量瓶,所以还缺失的仪器:500ml的容量瓶,故答案为:500ml容量瓶;
②a.转移时没有洗涤烧杯、玻璃棒,导致溶质的物质的量减小,所以偏小,故正确;
b.容量瓶内壁附有水珠而未干燥处理,不影响,故错误;
c.颠倒摇匀后发现凹液面低于刻度线又加水补上,体积变大,浓度偏小,故正确;
d.加水定容时俯视刻度线,体积偏小,浓度变大,故错误;
故选:a、c;
③n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,共失去电子的物质的量为2×0.02mol+0.02mol×[5-(-1)]=0.16mol,则消耗KMnO4的物质的量的是$\frac{0.16mol}{7-2}$=0.032mol,所以消耗KMnO4的体积为320mL,故答案为:320;
(5)①能证明氯水具有漂白性的是石蕊先变红后褪色,故答案为:d;溶液先变红后褪色;
②Cl2是新制氯水的主要成分,具有强氧化性,与KFeBr2发生氧化还原反应:3Cl2+2Fe 2++4Br-=6Cl-+2Fe 3++2Br2;
故答案为:3Cl2+2Fe 2++4Br-=6Cl-+2Fe 3++2Br2.
点评 本题考查据氯气的化学性质,学生要把握氯气的性质、氯水的成分及物质性质与用途的关系等为解答的关键,侧重分析、应用及计算能力的考查,题目难度不大.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | 单质的沸点:Y>Z | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型相同 |
| A. | 开展生态旅游 | B. | 发展畜牧业 | C. | 增加木材产量 | D. | 改善生态环境 |
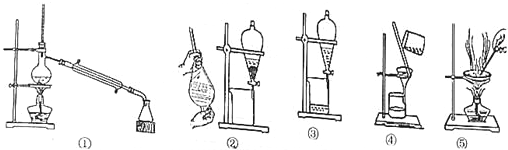
| 操作名称 | 适用对象或利用的物理性质 | 装置仪器 | 典型示例 |
| 过滤 | 除去江水中的泥沙 | ||
| 从食盐中获取NaCl晶体 | |||
| 将CCl4与水分离开 | |||
| ② | |||
| 蒸馏 | 从海水中获取淡水;工业上提纯酒精 |
| A. | 标准状况下,22.4L H2中所含质子数、中子数均为2NA | |
| B. | 46g NO2气体和46g N2O4气体的分子数之比为2:1 | |
| C. | 1L 1 mol•L-1的盐酸中所含粒子总数为2NA | |
| D. | 71g氯气与足量铁粉充分反应,转移的电子数为3NA |
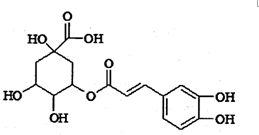 绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )
绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )| A. | 绿原酸分子中含有3种官能团 | |
| B. | 1 mol绿原酸最多能与7molNaOH发生反应 | |
| C. | 绿原酸能发生取代反应、加成反应和消去反应 | |
| D. | 绿原酸能使酸性高锰酸钾溶液、浓溴水褪色,但反应原理不同 |
| A. | 回收利用金属制品,废旧电池专门回收处理 | |
| B. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| C. | 大湖名城,水资源丰富,工业废水和生活污水可任意排放 | |
| D. | 合肥一六八中学开展“校园文明活动”、“光盘行动”、减少使用瓶装水 |
| A. | 向浓度为0.1 mol/L 的FeCl3和CuCl2混合溶液加入铁粉,CuCl2首先反应 | |
| B. | 向(NH4)2Fe(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反应 | |
| C. | 向浓度均为0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2气体,NaOH先反应 | |
| D. | 向浓度均为0.1 mol/L的FeBr2通入少量氯气,Br-首先反应 |