题目内容
根据下列反应的化学方程式:①Zn+CuSO4=ZnSO4+Cu、②Cu+2AgNO3=Cu(NO3)2+2Ag,判断三种金属的氧化性强弱顺序是( )
| A、Zn2+>Cu2+>Ag+ |
| B、Zn2+>Ag+>Cu2+ |
| C、Cu2+>Ag+>Zn2+ |
| D、Ag+>Cu2+>Zn2+ |
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:依据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性可以比较三种金属离子的氧化性强弱.
解答:
解:反应①Zn+CuSO4=ZnSO4+Cu中,CuSO4是氧化剂,ZnSO4是氧化产物,氧化性:Zn2+<Cu2+;
反应②Cu+2AgNO3=Cu(NO3)2+2Ag,AgNO3是氧化剂,Cu(NO3)2是氧化产物,所以氧化性:Ag+>Cu2+,
所以三种金属的氧化性强弱顺序:Ag+>Cu2+>Zn2+;
故选:D.
反应②Cu+2AgNO3=Cu(NO3)2+2Ag,AgNO3是氧化剂,Cu(NO3)2是氧化产物,所以氧化性:Ag+>Cu2+,
所以三种金属的氧化性强弱顺序:Ag+>Cu2+>Zn2+;
故选:D.
点评:本题考查了金属离子氧化性强弱顺序的比较,解题关键依据化合价的升降判断氧化剂和氧化产物,依据氧化剂的氧化性大于氧化产物的氧化性,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为( )
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为( )| A、2:5:4 |
| B、1:2:2 |
| C、2:2:1 |
| D、9:2:4 |
下列有关说法正确的是( )
| A、乙烯、苯、氯乙烯所有原子都在同一个平面上 |
| B、乙醇、乙酸均能与Na反应放出H2,二者分子中有相同的官能团 |
| C、葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 |
D、苹果醋是一种常见的有机酸,其结构简式为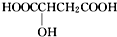 在标准状况下,1mol苹果醋与足量的金属钠反应生成的11.2L氢气 在标准状况下,1mol苹果醋与足量的金属钠反应生成的11.2L氢气 |
在0.1mol.L-1醋酸溶液中加入少量0.1mol.L-1盐酸,下列叙述正确的是( )
| A、CH3COOH的电离度减少,PH减小 |
| B、平衡向生成CH3COOH移动,c(H+)减小 |
| C、CH3COOH电离度增大,c(H+)增大 |
| D、电离平衡向生成CH3COO-、H+方向移动,PH减小 |
如图是常见四种有机物的比例模型示意图.下列说法正确的是( )

| A、甲能使酸性高锰酸钾溶液褪色 |
| B、乙可与溴水发生加成反应使溴水褪色 |
| C、丙中的碳碳键是碳碳单键和碳碳双键交替结合 |
| D、丁在稀硫酸作用下可与乙酸发生取代反应 |
某金属氯化物MCl240.5g,含有0.600molCl-,则金属M的摩尔质量为( )
| A、135 |
| B、64g?mol-1 |
| C、64 |
| D、135g?mol-1 |
除去MgO中的Al2O3可选用的试剂是( )
| A、NaOH溶液 | B、硝酸 |
| C、浓硫酸 | D、稀硫酸 |