题目内容
某化学兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去).

请回答下列问题:
(1)选择必要的仪器,按 顺序连接好装置(填装置序号).
(2)检验装置B气密性的方法: .
(3)实验时,在点燃酒精喷灯前必须进行的操作是 ,待装置E中出现 现象时,再点燃酒精喷灯,以上操作的目的是 .
(4)加热一段时间后观察到钠块表面变黑,继续加热后,钠燃烧,有白烟生成.两种产物中有一种是重要的化工原料,在玻璃工业中用量很大.则钠与二氧化碳反应的化学方程式是 .
(5)上述实验生成的黑色物质与浓硫酸在一定条件下反应会生成一种大气污染物,可利用酸性KMnO4溶液来测定该气体在空气中的含量,反应的离子方程式 ;判定反应是否需要指示剂(如果需要,选择何种指示剂,请描述现象.如果不需要,请说明理由.) .

请回答下列问题:
(1)选择必要的仪器,按
(2)检验装置B气密性的方法:
(3)实验时,在点燃酒精喷灯前必须进行的操作是
(4)加热一段时间后观察到钠块表面变黑,继续加热后,钠燃烧,有白烟生成.两种产物中有一种是重要的化工原料,在玻璃工业中用量很大.则钠与二氧化碳反应的化学方程式是
(5)上述实验生成的黑色物质与浓硫酸在一定条件下反应会生成一种大气污染物,可利用酸性KMnO4溶液来测定该气体在空气中的含量,反应的离子方程式
考点:性质实验方案的设计
专题:
分析:(1)根据实验原理设计装置,先制备二氧化碳,除杂,干燥,再与钠反应,再干燥等来设计;
(2)根据检查气密性的方法进行;
(3)从所用热源可知钠与二氧化碳的反应条件,为避免空气的影响,实验前先通二氧化碳充满装置后,再点燃酒精喷灯;
(4)钠燃烧,有白烟生成.两种产物中有一种是重要的化工原料,在玻璃工业中用量很大,其中一种固体为碳酸钠,另一种固体为C;
(5)根据酸性KMnO4溶液的强氧化性,二氧化硫的还原性结合得失电子守恒来书写氧化还原方程式;根据反应中是否有颜色变化来判断;
(2)根据检查气密性的方法进行;
(3)从所用热源可知钠与二氧化碳的反应条件,为避免空气的影响,实验前先通二氧化碳充满装置后,再点燃酒精喷灯;
(4)钠燃烧,有白烟生成.两种产物中有一种是重要的化工原料,在玻璃工业中用量很大,其中一种固体为碳酸钠,另一种固体为C;
(5)根据酸性KMnO4溶液的强氧化性,二氧化硫的还原性结合得失电子守恒来书写氧化还原方程式;根据反应中是否有颜色变化来判断;
解答:
解:(1)根据实验原理设计装置,先制备二氧化碳用“随开随用,随关随停”的B装置,除HCl用F,干燥用C,再与钠反应通D,再干燥用C,最后通E检验二氧化碳,故答案为:B、F、C、D、(C)、E;
(2)检验装置B气密性的方法为:塞紧双孔塞,关闭活塞,由长颈漏斗向试管内加水,到漏斗内液面超过试管内液面,形成一段液柱停止加水,一段时间后液柱不下降,证明装置气密性良好,
故答案为:塞紧双孔塞,关闭活塞,由长颈漏斗向试管内加水,到漏斗内液面超过试管内液面,形成一段液柱停止加水,一段时间后液柱不下降,证明装置气密性良好;
(3)从所用热源为酒精喷灯,可知钠与二氧化碳的反应条件为高温,避免空气中氧气、二氧化碳、水蒸气影响探究二氧化碳和钠反应的产物分析,需要先把装置中空气排出,打开Ⅲ的导气管活塞,先通一会CO2气,使装置充满二氧化碳气体后再点燃酒精喷灯;
故答案为:打开装置B中导气管活塞(或通入CO2); 澄清的石灰水变浑浊;排出装置中的空气;
(4)钠燃烧,有白烟生成.两种产物中有一种是重要的化工原料,在玻璃工业中用量很大,其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2
2Na2CO3+C;故答案为:4Na+3CO2
2Na2CO3+C;
(5)酸性KMnO4溶液的强氧化性,二氧化硫的还原性,则反应的氧化还原方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;因为反应中MnO4-→Mn2+溶液由紫红色变成无色,可以指示终点,所以不需要指示剂,
故答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;不需要指示剂,因为反应中MnO4-→Mn2+溶液由紫红色变成无色,可以指示终点.
(2)检验装置B气密性的方法为:塞紧双孔塞,关闭活塞,由长颈漏斗向试管内加水,到漏斗内液面超过试管内液面,形成一段液柱停止加水,一段时间后液柱不下降,证明装置气密性良好,
故答案为:塞紧双孔塞,关闭活塞,由长颈漏斗向试管内加水,到漏斗内液面超过试管内液面,形成一段液柱停止加水,一段时间后液柱不下降,证明装置气密性良好;
(3)从所用热源为酒精喷灯,可知钠与二氧化碳的反应条件为高温,避免空气中氧气、二氧化碳、水蒸气影响探究二氧化碳和钠反应的产物分析,需要先把装置中空气排出,打开Ⅲ的导气管活塞,先通一会CO2气,使装置充满二氧化碳气体后再点燃酒精喷灯;
故答案为:打开装置B中导气管活塞(或通入CO2); 澄清的石灰水变浑浊;排出装置中的空气;
(4)钠燃烧,有白烟生成.两种产物中有一种是重要的化工原料,在玻璃工业中用量很大,其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2
| ||
| ||
(5)酸性KMnO4溶液的强氧化性,二氧化硫的还原性,则反应的氧化还原方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;因为反应中MnO4-→Mn2+溶液由紫红色变成无色,可以指示终点,所以不需要指示剂,
故答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;不需要指示剂,因为反应中MnO4-→Mn2+溶液由紫红色变成无色,可以指示终点.
点评:本题考查了实验装置的选择,物质性质的实验设计验证分析应用,主要是钠及其化合物性质的判断理解,掌握基础是关键,题目难度中等.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
在标准状况下,将a L HCl(气)溶于1L水中(水的密度为1g?cm-3),得到的盐酸的密度为b g?mL-1,质量分数为w,物质的量浓度为c mol?L-1则下列关系式中正确的是( )
A、w=
| ||
B、w=
| ||
C、C=
| ||
D、b=
|
根据某种共性,可将SO2、CO2归为同一类物质.下列物质中也属于这类的是( )
| A、CaCO3 |
| B、SO3 |
| C、KMnO4 |
| D、Na2O |
常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A、滴入甲基橙显红色的溶液中:Na+、NO3-、I-、SO42- | ||
| B、水电离的c(H+)=10-12mol/L的溶液中:K+、AlO2-、CH3COO-、SiO32- | ||
C、
| ||
| D、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
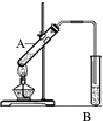 (1)实验室用右图所示装置制取乙酸乙酯,在试管A中加入的试剂有无水酒精、浓硫酸和冰醋酸(CH3COOH).请写出该反应的化学方程式)
(1)实验室用右图所示装置制取乙酸乙酯,在试管A中加入的试剂有无水酒精、浓硫酸和冰醋酸(CH3COOH).请写出该反应的化学方程式)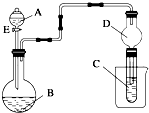 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题: